Για να υπολογίσουμε τα mol μιας ουσίας, ανάλογα με το τι στοιχεία μας δίνονται για την ουσία (Αριθμός μορίων, μάζα ή Όγκος), χρησιμοποιούμε κάποιον από τους παρακάτω τύπους:
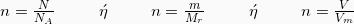
Όπου:
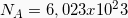 , Αριθμός Avogadro
, Αριθμός Avogadro
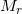 : Σχετική γραμμομοριακή μάζα
: Σχετική γραμμομοριακή μάζα
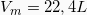 , Γραμμομοριακός όγκος σε STP (κανονικές συνθήκες πίεσης και θερμοκρασίας)
, Γραμμομοριακός όγκος σε STP (κανονικές συνθήκες πίεσης και θερμοκρασίας)
Μεθοδολογία επίλυσης ασκήσεων
- Βρίσκουμε τον αριθμό των mol από τη μάζα ή τον όγκο που μας δίνεται.
- Γράφουμε τη χημική αντίδραση που λαμβάνει χώρα.
- Γράφουμε τη σχέση mol με την οποία αντιδρούν ή παράγονται οι ουσίες (από τους συντελεστές).
- Γράφουμε κάτω από τη σχέση mol την δεδομένη ποσότητα και υπολογίζουμε τα ζητούμενα mol.
- Υπολογίζουμε την μάζα ή τον όγκο που ζητείται από τα mol που βρήκαμε.
Παράδειγμα
Πόσα γραμμάρια 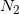 και πόσα mol
και πόσα mol 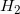 απαιτούνται για την παρασκευή 448L
απαιτούνται για την παρασκευή 448L 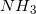 που μετρήθηκαν σε STP;
που μετρήθηκαν σε STP;
Δίνεται 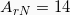
Λύση
Βήμα 1
Βρίσκουμε τα mol της 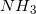 που θα παρασκευάσουμε:
που θα παρασκευάσουμε: 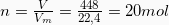
Βήμα 2
Γράφουμε τη χημική εξίσωση της αντίδρασης παρασκευής της αμμωνίας:
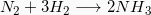
Βήμα 3-4
Κάτω από τη χημική αντίδραση γράφουμε την αναλογία των mol σύμφωνα με τους συντελεστές της χημικής αντίδρασης κι από κάτω τα mol της ουσίας που βρήκαμε στο 1ο βήμα.
![Rendered by QuickLaTeX.com \[ \begin{center} \begin{table}[] \begin{tabular}{ccccc} N_2 & + & 3 H_2 & \longrightarrow & 2 {NH}_3 \\ 1mol & &3mol&&2mol\\ \hline \multicolumn{1}{|c}{x} & & y & &\multicolumn{1}{c|}{20mol}\\ \hline \end{tabular} \end{table} \end{center} \]](https://blogs.sch.gr/koutenp/wp-content/ql-cache/quicklatex.com-e9ad7afd5c007e3b3320b55aca6b71b1_l3.png)
Υπολογίζουμε τα άγνωστα mol x και y κάνοντας χιαστί.
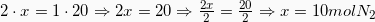
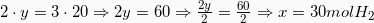
Άρα τώρα έχουμε:
![Rendered by QuickLaTeX.com \[ \begin{center} \begin{table}[] \begin{tabular}{ccccc} N_2 & + & 3 H_2 & \longrightarrow & 2 {NH}_3 \\ 1mol & &3mol&&2mol\\ \hline \multicolumn{1}{|c}{10mol} & & 30mol & &\multicolumn{1}{c|}{20mol}\\ \hline \end{tabular} \end{table} \end{center} \]](https://blogs.sch.gr/koutenp/wp-content/ql-cache/quicklatex.com-54f6e70f2a295e04a32f95a5f254b163_l3.png)
Προσοχή!
Θυμόμαστε πάντα ότι οι ποσότητες που έχουμε στην άσκηση είναι αυτές μέσα στο κουτάκι. Άρα αυτά τα mol θα χρησιμοποιούμε.
Βήμα 5
Υπολογίζουμε τα mol και τη μάζα που μας ζητάει η άσκηση.
Ήδη από το προηγούμενο βήμα υπολογίσαμε ότι χρειάζονται 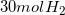 για την αντίδραση.
για την αντίδραση.
Για να υπολογίσουμε την μάζα του Αζώτου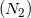 χρειαζόμαστε τη σχετική μοριακή του μάζα, άρα:
χρειαζόμαστε τη σχετική μοριακή του μάζα, άρα:
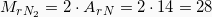
Τώρα υπολογίζουμε τη μάζα από τη σχέση:
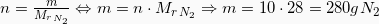
![]() , σχηματίζεται
, σχηματίζεται ![]() και η καύση ονομάζεται πλήρης ή τέλεια.
και η καύση ονομάζεται πλήρης ή τέλεια.![]()
![]() και σχηματίζεται
και σχηματίζεται ![]() .
.![]()

![Rendered by QuickLaTeX.com \[ \begin{center} \begin{table}[] \begin{tabular}{ccccc} N_2 & + & 3 H_2 & \longrightarrow & 2 {NH}_3 \\ 1mol & &3mol&&2mol\\ \hline \multicolumn{1}{|c}{x} & & y & &\multicolumn{1}{c|}{20mol}\\ \hline \end{tabular} \end{table} \end{center} \]](https://blogs.sch.gr/koutenp/wp-content/ql-cache/quicklatex.com-e9ad7afd5c007e3b3320b55aca6b71b1_l3.png)
![Rendered by QuickLaTeX.com \[ \begin{center} \begin{table}[] \begin{tabular}{ccccc} N_2 & + & 3 H_2 & \longrightarrow & 2 {NH}_3 \\ 1mol & &3mol&&2mol\\ \hline \multicolumn{1}{|c}{10mol} & & 30mol & &\multicolumn{1}{c|}{20mol}\\ \hline \end{tabular} \end{table} \end{center} \]](https://blogs.sch.gr/koutenp/wp-content/ql-cache/quicklatex.com-54f6e70f2a295e04a32f95a5f254b163_l3.png)
 Άρθρα (RSS)
Άρθρα (RSS)