Όταν το ηλιακό φως σκεδάζεται από τις σταγόνες βροχής, τότε εμφανίζονται πολύχρωμα τόξα σε ορισμένες περιοχές του ουρανού! Η απάντηση σε αυτό το λεπτό ερώτημα επιστρατεύει όλους τους πόρους της μαθηματικής φυσικής.
Το ουράνιο τόξο αποτελεί γέφυρα ανάμεσα σε δυο κουλτούρες: των ποιητών και των επιστημόνων που έχουν από καιρό κληθεί να το περιγράψουν. Η επιστημονική περιγραφή συχνά υποτίθεται ότι είναι ένα απλό πρόβλημα γεωμετρικής οπτικής, ένα πρόβλημα λυμένο πριν από πολύ καιρό και που σήμερα παρουσιάζει ενδιαφέρον μόνο ως ιστορική άσκηση.
Αυτό δεν ισχύει. Μια ικανοποιητική ποσοτική θεωρία του ουράνιου τόξου έχει αναπτυχτεί από τα μέσα του 20ου αιώνα. Επιπλέον, αυτή η θεωρία περιλαμβάνει πολύ περισσότερα από τη γεωμετρική οπτική. Βασίζεται σε όλα όσα γνωρίζουμε για τη φύση του φωτός. Πρέπει να ληφθούν υπόψη οι κυματικές ιδιότητες, όπως η συμβολή, η περίθλαση και η πόλωση, και οι σωματιδιακές ιδιότητες, όπως η ορμή που μεταφέρεται από μια δέσμη φωτός.
Μερικά από τα πιο ισχυρά εργαλεία της μαθηματικής φυσικής επιστρατεύτηκαν για να αντιμετωπίσουν το πρόβλημα του ουράνιου τόξου και σχετικά με αυτό προβλήματα. Πράγματι, το ουράνιο τόξο έχει χρησιμεύσει ως σημείο αναφοράς για τον έλεγχο των θεωριών της Οπτικής. Με την πιο επιτυχημένη από αυτές τις θεωρίες, είναι πλέον δυνατό να περιγραφεί το ουράνιο τόξο μαθηματικά, δηλαδή να προβλεφθεί η κατανομή του φωτός στον ουρανό.
Οι ίδιες μέθοδοι μπορούν επίσης να εφαρμοστούν σε σχετικά φαινόμενα, όπως ο φωτεινός δακτύλιος χρώματος που ονομάζεται σέλας, ακόμη και για άλλα είδη ουράνιων τόξων, όπως τα ατομικά και τα πυρηνικά.
 Η πρώτη προσπάθεια να εξηγηθεί ορθολογικά η εμφάνιση του ουράνιου τόξου ήταν του Αριστοτέλη. Πρότεινε ότι το ουράνιο τόξο είναι στην πραγματικότητα ένα ασυνήθιστο είδος ανάκλασης του ηλιακού φωτός από τα σύννεφα. Το φως ανακλάται υπό σταθερή γωνία, δημιουργώντας έναν κυκλικό κώνο «ακτίνων ουρανίου τόξου». Έτσι, ο Αριστοτέλης εξήγησε σωστά το κυκλικό σχήμα του τόξου και αντιλήφθηκε ότι δεν είναι ένα υλικό με καθορισμένη θέση στον ουρανό, αλλά μάλλον ένα σύνολο κατευθύνσεων κατά το μήκος του φωτός που διασκορπίζεται έντονα στα μάτια του παρατηρητή.
Η πρώτη προσπάθεια να εξηγηθεί ορθολογικά η εμφάνιση του ουράνιου τόξου ήταν του Αριστοτέλη. Πρότεινε ότι το ουράνιο τόξο είναι στην πραγματικότητα ένα ασυνήθιστο είδος ανάκλασης του ηλιακού φωτός από τα σύννεφα. Το φως ανακλάται υπό σταθερή γωνία, δημιουργώντας έναν κυκλικό κώνο «ακτίνων ουρανίου τόξου». Έτσι, ο Αριστοτέλης εξήγησε σωστά το κυκλικό σχήμα του τόξου και αντιλήφθηκε ότι δεν είναι ένα υλικό με καθορισμένη θέση στον ουρανό, αλλά μάλλον ένα σύνολο κατευθύνσεων κατά το μήκος του φωτός που διασκορπίζεται έντονα στα μάτια του παρατηρητή.
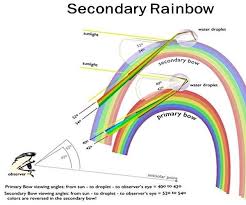
Η γωνία που σχηματίζεται από τις ακτίνες του ουράνιου τόξου και το προσπίπτον ηλιακό φως μετρήθηκε για πρώτη φορά το 1266 από τον Ρότζερ Μπέικον. Μέτρησε μια γωνία περίπου 42 μοιρών. Το δευτερεύον τόξο είναι περίπου οκτώ μοίρες ψηλότερα στον ουρανό. Σήμερα, αυτές οι γωνίες μετρώνται συνήθως από την αντίθετη κατεύθυνση, έτσι ώστε να μετράμε τη μεταβολή στην κατεύθυνση των ακτίνων του ήλιου. Η γωνία του πρωτεύοντος τόξου είναι επομένως (180 – 42) = 138 μοίρες. Αυτό ονομάζεται γωνία ουράνιου τόξου. Η γωνία του δευτερεύοντος τόξου είναι 130 μοίρες.

Από την εικασία του Αριστοτέλη, πέρασαν περίπου 17 αιώνες πριν σημειωθεί περαιτέρω σημαντική πρόοδος στη θεωρία του ουρανίου τόξου. Το 1304, ο Γερμανός μοναχός Theodoric of Freiberg απέρριψε την υπόθεση του Αριστοτέλη ότι το ουράνιο τόξο προκύπτει από τη συλλογική ανάκληση των σταγόνων βροχής σε ένα σύννεφο. Αντίθετα, πρότεινε ότι κάθε σταγόνα είναι ξεχωριστή ικανή να παράγει ένα ουράνιο τόξο. Επιπλέον, εξέτασε αυτήν την εικασία σε πειράματα με μια μεγεθυμένη σταγόνα βροχής: μια σφαιρική φιάλη γεμάτη με νερό. Μπόρεσε να εντοπίσει την πορεία που ακολουθούν οι ακτίνες φωτός που αποτελούν το ουράνιο τόξο.
Τα ευρήματα του Theodoric παρέμειναν σε μεγάλο βαθμό άγνωστα για τρεις αιώνες, μέχρι που ανακαλύφθηκαν από τον Decarte, ο οποίος χρησιμοποίησε την ίδια μέθοδο. Τόσο ο Theodoric όσο και ο Decatre έδειξαν ότι το ουράνιο τόξο αποτελείται από ακτίνες που εισέρχονται σε μια σταγόνα και ανακλώνται μία φορά από την εσωτερική επιφάνεια. Το δευτερεύον τόξο αποτελείται από ακτίνες που έχουν υποστεί δύο εσωτερικές ανακλάσεις. Με κάθε ανάκλαση χάνεται κάποιο φως, γεγονός που είναι ο κύριος λόγος για τον οποίο το δευτερεύον τόξο είναι πιο αμυδρό από το πρωτεύον. Οι Theodoric και Decatre σημείωσαν επίσης ότι κατά μήκος κάθε κατεύθυνσης εντός του γωνιακού εύρους που αντιστοιχεί στο ουράνιο τόξο, μόνο ένα χρώμα κάθε φορά μπορούσε να φανεί στο φως που σκεδαζόταν από την υδάτινη σφαίρα. Όταν το μάτι μετακινήθηκε σε μια νέα θέση για να εξερευνήσει άλλες γωνίες σκέδασης, τα άλλα φασματικά χρώματα εμφανίστηκαν, ένα προς ένα. Οι Theodoric και Decatre κατέληξαν στο συμπέρασμα ότι κάθε ένα από τα χρώματα στο ουράνιο τόξο φτάνει στο μάτι από ένα διαφορετικό σύνολο σταγονιδίων νερού.


Εικόνα: ΤΟ ΔΙΠΛΟ ΟΥΡΑΝΙΟ ΤΟΞΟ: Η φωτεινή, εσωτερική ζώνη είναι το κύριο τόξο. Χωρίζεται από το πιο αμυδρό δευτερεύον τόξο από μια περιοχή, που ονομάζεται σκοτεινή ζώνη του Αλεξάνδρου, η οποία είναι αισθητά πιο σκούρα από τον περιβάλλοντα ουρανό. Κάτω από το κύριο τόξο υπάρχουν μερικές αχνές ροζ και πράσινες ρίγες. Πρόκειται για υπεράριθμα τόξα. Το έργο της θεωρίας είναι να δώσει μια ποσοτική εξήγηση για καθένα από αυτά τα χαρακτηριστικά.
Όπως συνειδητοποίησαν ο Theodoric και Decatre, όλα τα κύρια χαρακτηριστικά του ουράνιου τόξου μπορούν να γίνουν κατανοητά μέσω μιας εξέτασης του φωτός που διέρχεται από μια μόνο σταγόνα. Οι θεμελιώδεις αρχές που καθορίζουν τη φύση του τόξου είναι αυτές που διέπουν την αλληλεπίδραση του φωτός με διαφανή μέσα, δηλαδή η ανάκλαση και η διάθλαση.
Ο νόμος της ανάκλασης είναι η γνωστή και διαισθητικά προφανής αρχή ότι η γωνία ανάκλασης πρέπει να ισούται με τη γωνία πρόσπτωσης. Ο νόμος της διάθλασης είναι κάπως πιο περίπλοκος. Ενώ η διαδρομή μιας ανακλώμενης ακτίνας καθορίζεται εξ ολοκλήρου από τη γεωμετρία, η διάθλαση περιλαμβάνει επίσης τις ιδιότητες του φωτός και τις ιδιότητες του μέσου.
Η ταχύτητα του φωτός στο κενό είναι αμετάβλητη. Μάλιστα, είναι μία από τις θεμελιώδεις σταθερές της φύσης. Η ταχύτητα του φωτός σε ένα υλικό μέσο, από την άλλη πλευρά, καθορίζεται από τις ιδιότητες του μέσου. Ο λόγος της ταχύτητας του φωτός στο κενό προς την ταχύτητα σε μια ουσία ονομάζεται δείκτης διάθλασης αυτής της ουσίας. Για τον αέρα ο δείκτης είναι ελάχιστα μεγαλύτερος από 1. Για το νερό είναι περίπου 1,33.
Μια ακτίνα φωτός που διέρχεται από τον αέρα στο νερό καθυστερεί στη διαχωριστική επιφάνεια. Αν χτυπήσει την επιφάνεια λοξά, η αλλαγή στην ταχύτητα έχει ως αποτέλεσμα μια αλλαγή στην κατεύθυνση. Τα ημίτονα των γωνιών πρόσπτωσης και διάθλασης είναι πάντα σε σταθερή αναλογία μεταξύ τους και η αναλογία είναι ίση με αυτήν μεταξύ των δεικτών διάθλασης για τα δύο υλικά. Αυτή η ισότητα ονομάζεται νόμος του Snell, από τον Willebrord Snell, ο οποίος τον διατύπωσε το 1621.
Μια προκαταρκτική ανάλυση του ουράνιου τόξου μπορεί να επιτευχθεί εφαρμόζοντας τους νόμους της ανάκλασης και της διάθλασης στην τροχιά μιας ακτίνας μέσα από μια σταγόνα. Επειδή η σταγόνα θεωρείται σφαιρική, όλες οι κατευθύνσεις είναι ισοδύναμες και υπάρχει μόνο μία σημαντική μεταβλητή: η μετατόπιση της προσπίπτουσας ακτίνας από έναν άξονα που διέρχεται από το κέντρο της σταγόνας. Αυτή η μετατόπιση ονομάζεται παράμετρος πρόσκρουσης. Κυμαίνεται από το μηδέν, όταν η ακτίνα συμπίπτει με τον κεντρικό άξονα, έως την ακτίνα της σταγόνας, όταν η ακτίνα είναι εφαπτομενική.
 Εικόνα: Η ΔΙΑΔΡΟΜΗ ΤΟΥ ΦΩΤΟΣ μέσα από μια σταγόνα μπορεί να προσδιοριστεί εφαρμόζοντας τους νόμους της γεωμετρικής οπτικής. Κάθε φορά που η δέσμη χτυπά την επιφάνεια, ένα μέρος του φωτός ανακλάται και ένα άλλο διαθλάται. Οι ακτίνες που ανακλώνται απευθείας από την επιφάνεια χαρακτηρίζονται ως ακτίνες Κλάσης 1. αυτές που μεταδίδονται απευθείας μέσω της σταγόνας χαρακτηρίζονται ως Κλάσης 2. Οι ακτίνες Κλάσης 3 εμφανίζονται μετά από μία εσωτερική ανάκλαση. Αυτές είναι που δημιουργούν το πρωτεύον ουράνιο τόξο. Το δευτερεύον τόξο αποτελείται από ακτίνες Κλάσης 4, οι οποίες έχουν υποστεί δύο εσωτερικές ανακλάσεις. Για τις ακτίνες κάθε κλάσης, μόνο ένας παράγοντας καθορίζει την τιμή της γωνίας σκέδασης. Αυτός ο παράγοντας είναι η παράμετρος πρόσκρουσης: η μετατόπιση της προσπίπτουσας ακτίνας από έναν άξονα που διέρχεται από το κέντρο της σταγόνας.
Εικόνα: Η ΔΙΑΔΡΟΜΗ ΤΟΥ ΦΩΤΟΣ μέσα από μια σταγόνα μπορεί να προσδιοριστεί εφαρμόζοντας τους νόμους της γεωμετρικής οπτικής. Κάθε φορά που η δέσμη χτυπά την επιφάνεια, ένα μέρος του φωτός ανακλάται και ένα άλλο διαθλάται. Οι ακτίνες που ανακλώνται απευθείας από την επιφάνεια χαρακτηρίζονται ως ακτίνες Κλάσης 1. αυτές που μεταδίδονται απευθείας μέσω της σταγόνας χαρακτηρίζονται ως Κλάσης 2. Οι ακτίνες Κλάσης 3 εμφανίζονται μετά από μία εσωτερική ανάκλαση. Αυτές είναι που δημιουργούν το πρωτεύον ουράνιο τόξο. Το δευτερεύον τόξο αποτελείται από ακτίνες Κλάσης 4, οι οποίες έχουν υποστεί δύο εσωτερικές ανακλάσεις. Για τις ακτίνες κάθε κλάσης, μόνο ένας παράγοντας καθορίζει την τιμή της γωνίας σκέδασης. Αυτός ο παράγοντας είναι η παράμετρος πρόσκρουσης: η μετατόπιση της προσπίπτουσας ακτίνας από έναν άξονα που διέρχεται από το κέντρο της σταγόνας.
Στην επιφάνεια της σταγόνας, η προσπίπτουσα ακτίνα ανακλάται εν μέρει, και αυτό το ανακλώμενο φως θα το αναγνωρίσουμε ως τις σκεδαζόμενες ακτίνες Κλάσης 1. Το υπόλοιπο φως μεταδίδεται στη σταγόνα (με αλλαγή κατεύθυνσης που προκαλείται από διάθλαση) και στην επόμενη επιφάνεια μεταδίδεται ξανά εν μέρει (ακτίνες Κλάσης 2) και ανακλάται εν μέρει. Στο επόμενο «όριο», η ανακλώμενη ακτίνα διασπάται ξανά σε ανακλώμενα και διαβιβαζόμενα συστατικά, και η διαδικασία συνεχίζεται επ’ αόριστον. Έτσι, η σταγόνα δημιουργεί μια σειρά από σκεδαζόμενες ακτίνες, συνήθως με ταχέως μειούμενη ένταση. Οι ακτίνες της Κλάσης 1 αντιπροσωπεύουν την άμεση ανάκλαση από τη σταγόνα και αυτές της Κλάσης 2 διαβιβάζονται απευθείας μέσω αυτής. Οι ακτίνες της Κλάσης 3 είναι αυτές που διαφεύγουν από τη σταγόνα μετά από μία εσωτερική ανάκλαση και αποτελούν το κύριο ουράνιο τόξο. Οι ακτίνες της Κλάσης 4, έχοντας υποστεί δύο εσωτερικές ανακλάσεις, δημιουργούν το δευτερεύον τόξο. Τα ουράνια τόξα ανώτερης τάξης σχηματίζονται από ακτίνες που δημιουργούν πιο περίπλοκα περάσματα, αλλά συνήθως δεν είναι ορατές.
 Εικόνα: Η ΓΕΩΜΕΤΡΙΑ ΤΟΥ ΟΥΡΑΝΙΟΥ ΤΟΞΟΥ καθορίζεται από τη γωνία σκέδασης: τη συνολική γωνία διαμέσου της οποίας μια ακτίνα ηλιακού φωτός κάμπτεται καθώς περνάει μέσα από μια σταγόνα βροχής. Οι ακτίνες είναι έντονα διασκορπισμένες σε γωνίες 138 μοιρών και 130 μοιρών, δημιουργώντας αντίστοιχα το πρωτεύον και το δευτερεύον ουράνιο τόξο. Μεταξύ αυτών των γωνιών πολύ λίγο φως εκτρέπεται. Αυτή είναι η περιοχή της σκοτεινής ζώνης του Αλεξάνδρου. Οι βέλτιστες γωνίες είναι ελαφρώς διαφορετικές για κάθε μήκος κύματος φωτός, με αποτέλεσμα τα χρώματα να διασκορπίζονται. Σημειώστε ότι η ακολουθία των χρωμάτων στο δευτερεύον τόξο είναι η αντίστροφη από αυτήν στο πρωτεύον τόξο. Δεν υπάρχει ένα μόνο επίπεδο στο οποίο βρίσκεται το ουράνιο τόξο. Το ουράνιο τόξο είναι απλώς το σύνολο των κατευθύνσεων κατά μήκος των οποίων το φως διασκορπίζεται προς τον παρατηρητή.
Εικόνα: Η ΓΕΩΜΕΤΡΙΑ ΤΟΥ ΟΥΡΑΝΙΟΥ ΤΟΞΟΥ καθορίζεται από τη γωνία σκέδασης: τη συνολική γωνία διαμέσου της οποίας μια ακτίνα ηλιακού φωτός κάμπτεται καθώς περνάει μέσα από μια σταγόνα βροχής. Οι ακτίνες είναι έντονα διασκορπισμένες σε γωνίες 138 μοιρών και 130 μοιρών, δημιουργώντας αντίστοιχα το πρωτεύον και το δευτερεύον ουράνιο τόξο. Μεταξύ αυτών των γωνιών πολύ λίγο φως εκτρέπεται. Αυτή είναι η περιοχή της σκοτεινής ζώνης του Αλεξάνδρου. Οι βέλτιστες γωνίες είναι ελαφρώς διαφορετικές για κάθε μήκος κύματος φωτός, με αποτέλεσμα τα χρώματα να διασκορπίζονται. Σημειώστε ότι η ακολουθία των χρωμάτων στο δευτερεύον τόξο είναι η αντίστροφη από αυτήν στο πρωτεύον τόξο. Δεν υπάρχει ένα μόνο επίπεδο στο οποίο βρίσκεται το ουράνιο τόξο. Το ουράνιο τόξο είναι απλώς το σύνολο των κατευθύνσεων κατά μήκος των οποίων το φως διασκορπίζεται προς τον παρατηρητή.
Για κάθε κατηγορία σκεδαζόμενων ακτίνων, η γωνία σκέδασης ποικίλλει σε ένα ευρύ φάσμα τιμών ως συνάρτηση της παραμέτρου πρόσκρουσης. Δεδομένου ότι στο ηλιακό φως η σταγόνα φωτίζεται ταυτόχρονα σε όλες τις παραμέτρους πρόσκρουσης, το φως σκεδάζεται σχεδόν σε όλες τις κατευθύνσεις. Δεν είναι δύσκολο να βρεθούν φωτεινές διαδρομές μέσα από τη σταγόνα που συμβάλλουν στο ουράνιο τόξο, αλλά υπάρχουν άπειρες άλλες διαδρομές που κατευθύνουν το φως αλλού. Γιατί, λοιπόν, η ένταση της σκεδασμένης ακτινοβολίας ενισχύεται κοντά στη γωνία του ουράνιου τόξου; Είναι ένα ερώτημα που ο Theodoric δεν εξέτασε. Η απάντηση δόθηκε για πρώτη φορά από τον Decarte.
Εφαρμόζοντας τους νόμους της ανάκλασης και της διάθλασης σε κάθε σημείο όπου μια ακτίνα προσπίπτει σε ένα όριο αέρα-νερού, ο Decarte υπολόγισε με σχολαστικότητα τις διαδρομές πολλών ακτίνων που προσπίπτουν σε πολλές παραμέτρους πρόσκρουσης. Οι ακτίνες της Κλάσης 3 έχουν κυρίαρχη σημασία. Όταν η παράμετρος πρόσκρουσης είναι μηδέν, αυτές οι ακτίνες σκεδάζονται υπό γωνία 180 μοιρών, δηλαδή, σκεδάζονται προς τα πίσω προς τον ήλιο, έχοντας περάσει από το κέντρο της σταγόνας και ανακλαστεί από το μακρινό τοίχωμα. Καθώς η παράμετρος πρόσκρουσης αυξάνεται και οι προσπίπτουσες ακτίνες μετατοπίζονται από το κέντρο της σταγόνας, η γωνία σκέδασης μειώνεται. Ο Decarte διαπίστωσε, ωστόσο, ότι αυτή η τάση δεν συνεχίζεται καθώς η παράμετρος πρόσκρουσης αυξάνεται στη μέγιστη τιμή της, όπου η προσπίπτουσα ακτίνα εφάπτεται της σταγόνας. Αντίθετα, η γωνία σκέδασης διέρχεται από ένα ελάχιστο όταν η παράμετρος πρόσκρουσης είναι περίπου τα επτά όγδοα της ακτίνας της σταγόνας και στη συνέχεια αυξάνεται ξανά. Η γωνία σκέδασης στο ελάχιστο είναι 138 μοίρες.
Για ακτίνες Κλάσης 4, η γωνία σκέδασης είναι μηδέν όταν η παράμετρος πρόσκρουσης είναι μηδέν. Με άλλα λόγια, η κεντρική ακτίνα ανακλάται δύο φορές και στη συνέχεια συνεχίζει στην αρχική της κατεύθυνση. Καθώς αυξάνεται η παράμετρος πρόσκρουσης, αυξάνεται και η γωνία σκέδασης, αλλά και πάλι η τάση τελικά αντιστρέφεται, αυτή τη φορά στις 130 μοίρες. Οι ακτίνες Κλάσης 4 έχουν μέγιστη γωνία σκέδασης 130 μοιρών και καθώς η παράμετρος πρόσκρουσης αυξάνεται περαιτέρω, κάμπτονται ξανά προς τα πίσω προς την κατεύθυνση σκέδασης προς τα εμπρός.

Εικόνα: Η ΑΝΑΚΛΑΣΗ ΚΑΙ Η ΔΙΑΘΛΑΣΗ του φωτός στα όρια μεταξύ αέρα και νερού είναι τα βασικά γεγονότα στη δημιουργία ενός ουράνιου τόξου. Στην ανάκλαση, η γωνία πρόσπτωσης είναι ίση με τη γωνία ανάκλασης. Στη διάθλαση, η γωνία της διερχόμενης ακτίνας καθορίζεται από τις ιδιότητες του μέσου, όπως χαρακτηρίζονται από τον δείκτη διάθλασής του. Το φως που εισέρχεται σε ένα μέσο με υψηλότερο δείκτη κάμπτεται προς την κάθετο. Το φως διαφορετικών μηκών κύματος διαθλάται μέσω ελαφρώς διαφορετικών γωνιών. Αυτή η εξάρτηση του δείκτη διάθλασης από το χρώμα ονομάζεται διασπορά. Οι θεωρίες του ουράνιου τόξου συχνά ασχολούνται ξεχωριστά με κάθε μονοχρωματικό συστατικό του προσπίπτοντος φωτός.
Επειδή μια σταγόνα στο ηλιακό φως φωτίζεται ομοιόμορφα, οι παράμετροι πρόσκρουσης των προσπιπτουσών ακτίνων κατανέμονται ομοιόμορφα. Η συγκέντρωση του σκεδαζόμενου φωτός αναμένεται επομένως να είναι μεγαλύτερη όπου η γωνία σκέδασης μεταβάλλεται πιο αργά με τις αλλαγές στην παράμετρο πρόσκρουσης. Με άλλα λόγια, το σκεδαζόμενο φως είναι πιο φωτεινό όπου συγκεντρώνει τις προσπίπτουσες ακτίνες από το μεγαλύτερο εύρος παραμέτρων πρόσκρουσης. Οι περιοχές ελάχιστης μεταβολής είναι αυτές που περιβάλλουν τη μέγιστη και ελάχιστη γωνία σκέδασης, και έτσι εξηγείται η ειδική κατάσταση των πρωτευουσών και δευτερευουσών γωνιών ουράνιου τόξου. Επιπλέον, δεδομένου ότι δεν υπάρχουν ακτίνες Κλάσης 3 ή Κλάσης 4 που να σκεδάζονται στην γωνιακή περιοχή μεταξύ 130 και 138 μοιρών, εξηγείται επίσης η σκοτεινή ζώνη του Αλεξάντερ.


Εικόνα: Η ΓΩΝΙΑ ΟΥΡΑΝΙΟΥ ΤΟΞΟΥ μπορεί να θεωρηθεί ότι έχει ιδιαίτερη σημασία όταν η γωνία σκέδασης θεωρείται ως συνάρτηση της παραμέτρου πρόσκρουσης. Όταν η παράμετρος πρόσκρουσης είναι μηδέν, η γωνία σκέδασης για μια ακτίνα Κλάσης 3 είναι 180 μοίρες. Η ακτίνα διέρχεται από το κέντρο της σταγόνας και ανακλάται από την μακρινή επιφάνεια κατευθείαν πίσω στον ήλιο. Καθώς η παράμετρος πρόσκρουσης αυξάνεται, η γωνία σκέδασης μειώνεται, αλλά τελικά επιτυγχάνεται μια ελάχιστη γωνία. Αυτή η ακτίνα ελάχιστης εκτροπής είναι η ακτίνα ουράνιου τόξου στο διάγραμμα στα αριστερά. Οι ακτίνες με παραμέτρους πρόσκρουσης σε κάθε πλευρά της σκεδάζονται σε μεγαλύτερες γωνίες. Η ελάχιστη εκτροπή είναι περίπου 138 μοίρες και η μεγαλύτερη συγκέντρωση σκεδαζόμενων ακτίνων βρίσκεται κοντά σε αυτή τη γωνία. Η προκύπτουσα ενίσχυση στην ένταση του σκεδαζόμενου φωτός γίνεται αντιληπτή ως το πρωτεύον ουράνιο τόξο. Το δευτερεύον τόξο σχηματίζεται με παρόμοιο τρόπο, εκτός από το ότι η γωνία σκέδασης για τις ακτίνες Κλάσης 4 από τις οποίες αποτελείται αυξάνεται στο μέγιστο αντί να μειώνεται στο ελάχιστο. Το μέγιστο βρίσκεται περίπου στις 130 μοίρες. Καμία ακτίνα της Κλάσης 3 ή της Κλάσης 4 δεν μπορεί να φτάσει σε γωνίες μεταξύ 130 μοιρών και 138 μοιρών, γεγονός που εξηγεί την ύπαρξη της σκοτεινής ζώνης του Αλεξάνδρου. Στα αριστερά, δύο ακτίνες Κλάσης 3, με παραμέτρους πρόσκρουσης σε κάθε πλευρά της τιμής του ουράνιου τόξου, αναδύονται με την ίδια γωνία σκέδασης. Είναι η συμβολή μεταξύ ακτίνων όπως αυτές οι δύο που δημιουργεί τα υπεράριθμα τόξα.
Η θεωρία του Decarte μπορεί να γίνει πιο σαφής εξετάζοντας έναν φανταστικό πληθυσμό σταγονιδίων από τα οποία το φως διασκορπίζεται με κάποιο τρόπο με ομοιόμορφη ένταση προς όλες τις κατευθύνσεις. Ένας ουρανός γεμάτος με τέτοιες σταγόνες θα ήταν ομοιόμορφα φωτεινός σε όλες τις γωνίες. Σε έναν ουρανό γεμάτο με πραγματικές σταγόνες νερού, η ίδια συνολική φωτεινότητα είναι διαθέσιμη, αλλά αναδιανέμεται. Τα περισσότερα μέρη του ουρανού είναι πιο αμυδρά από ό,τι θα ήταν με ομοιόμορφη σκέδαση, αλλά κοντά στη γωνία του ουράνιου τόξου υπάρχει ένα φωτεινό τόξο, που σταδιακά μειώνεται στην φωτεινή πλευρά και πιο έντονα στη σκοτεινή πλευρά. Το δευτερεύον τόξο είναι ένα παρόμοιας έντασης φως, εκτός από το ότι είναι στενότερο και όλα τα χαρακτηριστικά του είναι πιο αμυδρά. Στην καρτεσιανή θεωρία, η περιοχή ανάμεσα στα τόξα είναι σαφώς πιο σκοτεινή από τον ουρανό αλλού. Αν υπήρχαν μόνο ακτίνες της Κατηγορίας 3 και 4, θα ήταν αρκετά μαύρη.
Το Καρτεσιανό ουράνιο τόξο είναι ένα αξιοσημείωτα απλό φαινόμενο. Η φωτεινότητα είναι συνάρτηση του ρυθμού με τον οποίο αλλάζει η γωνία σκέδασης. Αυτή η γωνία καθορίζεται από δύο μόνο παράγοντες: τον δείκτη διάθλασης, ο οποίος θεωρείται σταθερός, και την παράμετρο πρόσκρουσης, η οποία θεωρείται ομοιόμορφα κατανεμημένη. Ένας παράγοντας που δεν έχει καμία επίδραση στη γωνία του ουράνιου τόξου είναι το μέγεθος: η γεωμετρία της σκέδασης είναι η ίδια για μικρά σταγονίδια νεφών και για τις μεγάλες σφαίρες γεμάτες νερό που χρησιμοποίησαν οι Theodoric και Decatre.
Μέχρι στιγμής έχουμε αγνοήσει ένα από τα πιο εμφανή χαρακτηριστικά του ουράνιου τόξου: τα χρώματά του. Εξηγήθηκαν, φυσικά, από τον Νεύτωνα, στα πειράματά του με πρίσματα του 1666. Αυτά τα πειράματα απέδειξαν όχι μόνο ότι το λευκό φως είναι ένα μείγμα χρωμάτων, αλλά και ότι ο δείκτης διάθλασης είναι διαφορετικός για κάθε χρώμα, το φαινόμενο που ονομάζεται διασπορά. Συνεπώς, κάθε χρώμα ή μήκος κύματος του φωτός πρέπει να έχει τη δική του γωνία ουράνιου τόξου. Αυτό που παρατηρούμε στη φύση είναι μια συλλογή από μονοχρωματικά ουράνια τόξα, το καθένα ελαφρώς μετατοπισμένο από το επόμενο.
Από τις μετρήσεις του δείκτη διάθλασης, ο Νεύτωνας υπολόγισε ότι η γωνία του ουράνιου τόξου είναι 137 μοίρες και 58 λεπτά για το κόκκινο φως και 139 μοίρες και 43 λεπτά για το ιώδες φως. Η διαφορά μεταξύ αυτών των γωνιών είναι μία μοίρα και 45 λεπτά, που θα ήταν το πλάτος του ουράνιου τόξου αν οι ακτίνες του προσπίπτοντος ηλιακού φωτός ήταν ακριβώς παράλληλες. Υπολογίζοντας μισή μοίρα για τη φαινομενική διάμετρο του ήλιου, ο Νεύτωνας έλαβε ένα συνολικό πλάτος δύο μοιρών και 15 λεπτών για το κύριο τόξο. Οι δικές του παρατηρήσεις συμφωνούσαν σε μεγάλο βαθμό με αυτό το αποτέλεσμα.
Ο Decarte και ο Νεύτωνας μπόρεσαν να εξηγήσουν όλα τα πιο εμφανή χαρακτηριστικά του ουράνιου τόξου. Εξήγησαν την ύπαρξη του κύριου και του δευτερεύοντος τόξου και της σκοτεινής ζώνης που τα χωρίζει. Υπολόγισαν τις γωνιακές θέσεις αυτών των χαρακτηριστικών και περιέγραψαν τη διασπορά του σκεδαζόμενου φωτός σε ένα φάσμα. Όλα αυτά επιτεύχθηκαν μόνο με γεωμετρική οπτική. Η θεωρία τους, ωστόσο, είχε ένα σημαντικό μειονέκτημα: δεν μπορούσε να εξηγήσει τα υπεράριθμα τόξα. Η κατανόηση αυτών των φαινομενικά δευτερευόντων χαρακτηριστικών απαιτεί μια πιο εξελιγμένη άποψη για τη φύση του φωτός.
Τα υπεράριθμα τόξα εμφανίζονται στην εσωτερική ή φωτισμένη πλευρά του πρωτεύοντος τόξου. Σε αυτήν την γωνιακή περιοχή, δύο σκεδασμένες ακτίνες Κλάσης 3 αναδύονται προς την ίδια κατεύθυνση. Προκύπτουν από προσπίπτουσες ακτίνες που έχουν παραμέτρους πρόσκρουσης σε κάθε πλευρά της τιμής του ουράνιου τόξου. Έτσι, σε οποιαδήποτε δεδομένη γωνία ελαφρώς μεγαλύτερη από τη γωνία του ουράνιου τόξου, το σκεδαζόμενο φως περιλαμβάνει ακτίνες που έχουν ακολουθήσει δύο διαφορετικές διαδρομές μέσα από τη σταγόνα. Οι ακτίνες αναδύονται σε διαφορετικές θέσεις στην επιφάνεια της σταγόνας, αλλά προχωρούν προς την ίδια κατεύθυνση.
Στην εποχή του Decarte και του Νεύτωνα, αυτές οι δύο συνεισφορές στη σκεδαζόμενη ένταση μπορούσαν να αντιμετωπιστούν μόνο με απλή πρόσθεση. Ως αποτέλεσμα, η προβλεπόμενη ένταση μειώνεται ομαλά με απόκλιση από τη γωνία του ουράνιου τόξου, χωρίς ίχνος υπεράριθμων τόξων. Στην πραγματικότητα, οι εντάσεις των δύο ακτίνων δεν μπορούν να προστεθούν επειδή δεν είναι ανεξάρτητες πηγές ακτινοβολίας.
Το οπτικό φαινόμενο που κρύβεται πίσω από τα υπεράριθμα τόξα ανακαλύφθηκε το 1803 από τον Thomas Young, ο οποίος έδειξε ότι το φως είναι ικανό για συμβολή, ένα φαινόμενο που ήταν ήδη γνωστό από τη μελέτη των υδάτινων κυμάτων. Σε οποιοδήποτε μέσο, η υπέρθεση κυμάτων μπορεί να οδηγήσει είτε σε ενίσχυση (κορυφή πάνω στην κορυφή) είτε σε ακύρωση (κορυφή πάνω στην κοίλη). Ο Young απέδειξε την συμβολή των φωτεινών κυμάτων περνώντας μια δέσμη μονοχρωματικού φωτός μέσα από δύο οπές και παρατηρώντας τις εναλλασσόμενες φωτεινές και σκοτεινές «κρόσσια» που παράγονταν. Ο ίδιος ο Young ήταν αυτός που επεσήμανε τη σημασία της ανακάλυψής του για τα υπεράριθμα τόξα του «ουράνιου τόξου». Οι δύο ακτίνες που σκεδάζονται στην ίδια κατεύθυνση από μια σταγόνα βροχής είναι αυστηρά ανάλογες με το φως που διέρχεται από τις δύο οπές στο πείραμα του Young.
Σε γωνίες πολύ κοντά στη γωνία του ουράνιου τόξου, οι δύο διαδρομές μέσα από τη σταγόνα «διαφέρουν μόνο ελαφρώς, και έτσι οι δύο ακτίνες «συμβάλλουν εποικοδομητικά». Καθώς η γωνία αυξάνεται, οι δύο ακτίνες ακολουθούν διαδρομές ουσιαστικά διαφορετικού μήκους. Όταν η διαφορά ισούται με το μισό του μήκους κύματος, η συμβολή είναι εντελώς καταστροφική. Σε ακόμη μεγαλύτερες γωνίες οι δέσμες ενισχύονται ξανά. Το αποτέλεσμα είναι μια περιοδική μεταβολή στην ένταση του σκεδαζόμενου φωτός, μια σειρά από εναλλασσόμενες φωτεινές και σκοτεινές ζώνες.
 Εικόνα: Η συμβολή των ακτίνων που σκεδάζονται από μια σταγόνα δημιουργεί καυστικά, ή «καμπύλες καύσης». Ένα καυστικό είναι το περίβλημα ενός συστήματος ακτίνων. Ιδιαίτερο ενδιαφέρον παρουσιάζει το καυστικό των ακτίνων Κλάσης 3, το οποίο έχει δύο κλάδους, έναν πραγματικό κλάδο και έναν «εικονικό». Ο τελευταίος σχηματίζεται όταν οι ακτίνες εκτείνονται προς τα πίσω. Όταν η ακτίνα ουράνιου τόξου παράγεται και προς τις δύο κατευθύνσεις, πλησιάζει τους κλάδους αυτού του καυστικού. Μια θεωρία του ουράνιου τόξου βασισμένη στην ανάλυση ενός τέτοιου καυστικού επινοήθηκε από τον George B. Airy. Έχοντας επιλέξει ένα αρχικό μέτωπο κύματος – μια επιφάνεια κάθετη σε όλα τα σημεία στις ακτίνες της Κλάσης 3 – ο Airy μπόρεσε να προσδιορίσει την κατανομή πλάτους στα επόμενα κύματα. Μια αδυναμία της θεωρίας είναι η ανάγκη να μαντέψουμε τα πλάτη των αρχικών κυμάτων.
Εικόνα: Η συμβολή των ακτίνων που σκεδάζονται από μια σταγόνα δημιουργεί καυστικά, ή «καμπύλες καύσης». Ένα καυστικό είναι το περίβλημα ενός συστήματος ακτίνων. Ιδιαίτερο ενδιαφέρον παρουσιάζει το καυστικό των ακτίνων Κλάσης 3, το οποίο έχει δύο κλάδους, έναν πραγματικό κλάδο και έναν «εικονικό». Ο τελευταίος σχηματίζεται όταν οι ακτίνες εκτείνονται προς τα πίσω. Όταν η ακτίνα ουράνιου τόξου παράγεται και προς τις δύο κατευθύνσεις, πλησιάζει τους κλάδους αυτού του καυστικού. Μια θεωρία του ουράνιου τόξου βασισμένη στην ανάλυση ενός τέτοιου καυστικού επινοήθηκε από τον George B. Airy. Έχοντας επιλέξει ένα αρχικό μέτωπο κύματος – μια επιφάνεια κάθετη σε όλα τα σημεία στις ακτίνες της Κλάσης 3 – ο Airy μπόρεσε να προσδιορίσει την κατανομή πλάτους στα επόμενα κύματα. Μια αδυναμία της θεωρίας είναι η ανάγκη να μαντέψουμε τα πλάτη των αρχικών κυμάτων.
Επειδή οι γωνίες σκέδασης στις οποίες η παρεμβολή τυχαίνει να είναι κατασκευαστική καθορίζονται από τη διαφορά μεταξύ δύο μηκών διαδρομής, αυτές οι γωνίες επηρεάζονται από την ακτίνα της σταγόνας. Το μοτίβο των υπεράριθμων τόξων (σε αντίθεση με τη γωνία του ουράνιου τόξου) εξαρτάται, επομένως, από το μέγεθος της σταγόνας. Σε μεγαλύτερες σταγόνες, η διαφορά στο μήκος της διαδρομής αυξάνεται πολύ πιο γρήγορα με την παράμετρο πρόσκρουσης από ό,τι σε μικρές σταγόνες. Επομένως, όσο μεγαλύτερες είναι οι σταγόνες, τόσο στενότερη είναι η γωνιακή απόσταση μεταξύ των υπεράριθμων τόξων. Τα τόξα σπάνια διακρίνονται εάν οι σταγόνες έχουν διάμετρο μεγαλύτερη από περίπου ένα χιλιοστό. Η επικάλυψη των χρωμάτων τείνει επίσης να ξεθωριάζει τα τόξα. Η εξάρτηση των υπεράριθμων από το μέγεθος εξηγεί γιατί είναι πιο εύκολο να τα δούμε κοντά στην κορυφή της σταγόνας: οι σταγόνες βροχής τείνουν να μεγαλώνουν καθώς πέφτουν.
Με τη θεωρία συμβολής του Young, όλα τα κύρια χαρακτηριστικά του ουράνιου τόξου μπορούσαν να εξηγηθούν, τουλάχιστον με ποιοτικό και προσεγγιστικό τρόπο. Αυτό που έλειπε ήταν μια ποσοτική, μαθηματική θεωρία ικανή να προβλέψει την ένταση του σκεδαζόμενου φωτός ως συνάρτηση του μεγέθους των σταγονιδίων και της γωνίας σκέδασης.
Η εξήγηση του Young για τα υπεράριθμα τόξα βασιζόταν σε μια κυματική θεωρία του φωτός. Παραδόξως, οι προβλέψεις του για την άλλη πλευρά του ουράνιου τόξου, για την περιοχή της σκοτεινής ζώνης του Αλεξάνδρου, ήταν ασυμβίβαστες με μια τέτοια θεωρία. Η θεωρία συμβολής, όπως και οι θεωρίες του Descartes και του Newton, προέβλεπαν πλήρες σκοτάδι σε αυτήν την περιοχή, τουλάχιστον όταν λαμβάνονταν υπόψη μόνο οι ακτίνες της Κλάσης 3 και 4. Μια τέτοια απότομη μετάβαση, ωστόσο, δεν είναι δυνατή, επειδή η κυματική θεωρία του φωτός απαιτεί τα αιχμηρά όρια μεταξύ φωτός και σκιάς να μαλακώνουν με περίθλαση. Η πιο γνωστή εκδήλωση της περίθλασης είναι η φαινομενική κάμψη του φωτός ή του ήχου στην άκρη ενός αδιαφανούς εμποδίου. Στο ουράνιο τόξο δεν υπάρχει πραγματικό εμπόδιο, αλλά το όριο μεταξύ του πρωτεύοντος τόξου και της σκοτεινής ζώνης θα έπρεπε να παρουσιάζει περίθλαση παρόλα αυτά. Η αντιμετώπιση της περίθλασης είναι ένα λεπτό και δύσκολο πρόβλημα στη μαθηματική φυσική, και η επακόλουθη ανάπτυξη της θεωρίας του ουράνιου τόξου υποκινήθηκε κυρίως από τις προσπάθειες επίλυσής της.
 Εικόνα: Η ΠΡΟΒΛΕΠΟΜΕΝΗ ΕΝΤΑΣΗ ως συνάρτηση της γωνίας σκέδασης συγκρίνεται για τρεις πρώιμες θεωρίες του ουράνιου τόξου. Στη γεωμετρική ανάλυση του Ντεκάρτ, η ένταση είναι άπειρη στη γωνία του ουράνιου τόξου. Μειώνεται ομαλά (χωρίς υπεράριθμα τόξα) στην φωτεινή πλευρά και πέφτει απότομα στο μηδέν στη σκοτεινή πλευρά. Η θεωρία του Τόμας Γιανγκ, η οποία βασίζεται στην συμβολή των φωτεινών κυμάτων, προβλέπει υπεράριθμα τόξα αλλά διατηρεί την απότομη μετάβαση από την άπειρη ένταση στη μηδενική. Η θεωρία του Airy μετατοπίζει τις κορυφές στην καμπύλη έντασης και για πρώτη φορά παρέχει (μέσω περίθλασης) μια εξήγηση για τη σταδιακή εξασθένιση του ουράνιου τόξου στη σκιά.
Εικόνα: Η ΠΡΟΒΛΕΠΟΜΕΝΗ ΕΝΤΑΣΗ ως συνάρτηση της γωνίας σκέδασης συγκρίνεται για τρεις πρώιμες θεωρίες του ουράνιου τόξου. Στη γεωμετρική ανάλυση του Ντεκάρτ, η ένταση είναι άπειρη στη γωνία του ουράνιου τόξου. Μειώνεται ομαλά (χωρίς υπεράριθμα τόξα) στην φωτεινή πλευρά και πέφτει απότομα στο μηδέν στη σκοτεινή πλευρά. Η θεωρία του Τόμας Γιανγκ, η οποία βασίζεται στην συμβολή των φωτεινών κυμάτων, προβλέπει υπεράριθμα τόξα αλλά διατηρεί την απότομη μετάβαση από την άπειρη ένταση στη μηδενική. Η θεωρία του Airy μετατοπίζει τις κορυφές στην καμπύλη έντασης και για πρώτη φορά παρέχει (μέσω περίθλασης) μια εξήγηση για τη σταδιακή εξασθένιση του ουράνιου τόξου στη σκιά.
Το 1835 ο Richard Potter του Πανεπιστημίου του Cambridge επεσήμανε ότι η διασταύρωση διαφόρων συνόλων φωτεινών ακτίνων σε μια σταγόνα δημιουργεί καυστικές καμπύλες. Μια καυστική, ή «καμπύλη καύσης», αντιπροσωπεύει το περίβλημα ενός συστήματος ακτίνων και συνδέεται πάντα με μια έντονη ένταση. Μια οικεία καυστική είναι η φωτεινή καμπύλη σε σχήμα αιχμής που σχηματίζεται σε ένα φλιτζάνι τσαγιού όταν το ηλιακό φως ανακλάται από τα εσωτερικά του τοιχώματα. Οι καυστικές, όπως και το ουράνιο τόξο, έχουν γενικά μια φωτεινή πλευρά και μια σκοτεινή πλευρά. Η ένταση αυξάνεται συνεχώς μέχρι την καυστική, και στη συνέχεια μειώνεται απότομα.
Ο Potter έδειξε ότι η ακτίνα ουράνιου τόξου Descartes – η ακτίνα Κλάσης 3 με ελάχιστη γωνία σκέδασης – μπορεί να θεωρηθεί ως καυστική. Όλες οι άλλες διαδιδόμενες ακτίνες Κλάσης 3, όταν εκτείνονται στο άπειρο, πλησιάζουν την ακτίνα Descartes από τη φωτισμένη πλευρά. Δεν υπάρχουν ακτίνες αυτής της κατηγορίας στη σκοτεινή πλευρά. Έτσι, η εύρεση της έντασης του σκεδαζόμενου φωτός σε ένα ουράνιο τόξο είναι παρόμοια με το πρόβλημα του προσδιορισμού της κατανομής της έντασης στην περιοχή ενός καυστικού.
Το 1838, ο συνάδελφος του Πότερ στο Κέιμπριτζ, Τζορτζ Μπ. Αίρι, προσπάθησε να προσδιορίσει αυτή την κατανομή. Η συλλογιστική του βασίστηκε σε μια αρχή της διάδοσης κυμάτων που διατυπώθηκε τον 17ο αιώνα από τον Κρίστιαν Χόιχενς και αργότερα αναπτύχθηκε από τον Αυγουστίνο Ζαν Φρεσνέλ. Αυτή η αρχή θεωρεί κάθε σημείο ενός μετώπου κύματος ως πηγή δευτερογενών σφαιρικών κυμάτων. Τα δευτερογενή κύματα ορίζουν ένα νέο μέτωπο κύματος και, ως εκ τούτου, περιγράφουν τη διάδοση του κύματος. Συνεπώς, αν κάποιος γνώριζε τα πλάτη των κυμάτων σε οποιοδήποτε πλήρες μέτωπο κύματος, η κατανομή πλάτους σε οποιοδήποτε άλλο σημείο θα μπορούσε να ανακατασκευαστεί. Ολόκληρο το ουράνιο τόξο θα μπορούσε να περιγραφεί αυστηρά αν γνωρίζαμε την κατανομή πλάτους κατά μήκος ενός μετώπου κύματος σε μία μόνο σταγόνα. Δυστυχώς, η κατανομή πλάτους σπάνια μπορεί να προσδιοριστεί. Το μόνο που μπορεί κανείς να κάνει είναι να κάνει μια λογική εικασία για κάποιο επιλεγμένο μέτωπο κύματος με την ελπίδα ότι αυτό θα οδηγήσει σε μια καλή προσέγγιση. Το αρχικό μέτωπο κύματος που επέλεξε ο Airy είναι μια επιφάνεια μέσα στη σταγόνα, κανονική για όλες τις ακτίνες της Κλάσης 3 και με ένα σημείο καμπής (μια αλλαγή στην έννοια της καμπυλότητας) όπου τέμνει την ακτίνα ουράνιου τόξου Descartes. Τα πλάτη κύματος κατά μήκος αυτού του μετώπου κύματος εκτιμήθηκαν μέσω τυπικών υποθέσεων στη θεωρία της περίθλασης. Ο Airy μπόρεσε στη συνέχεια να εκφράσει την ένταση του σκεδαζόμενου φωτός στην περιοχή του ουράνιου τόξου με όρους μιας νέας μαθηματικής συνάρτησης, τότε γνωστής ως ολοκλήρωμα ουράνιου τόξου και σήμερα ονομάζεται συνάρτηση Airy. Η μαθηματική μορφή της συνάρτησης Airy δεν θα μας απασχολήσει εδώ. Θα επικεντρωθούμε αντ’ αυτού στη φυσική της σημασία.
Η κατανομή έντασης που προβλέπεται από τη συνάρτηση Airy είναι ανάλογη με το μοτίβο περίθλασης που εμφανίζεται στη σκιά μιας ευθείας ακμής. Στην φωτισμένη πλευρά του πρωτεύοντος τόξου υπάρχουν ταλαντώσεις στην ένταση που αντιστοιχούν στα υπεράριθμα τόξα. Οι θέσεις και τα πλάτη αυτών των κορυφών διαφέρουν κάπως από αυτά που προβλέπονται από τη θεωρία συμβολής Young. Μια άλλη σημαντική διάκριση της θεωρίας Airy είναι ότι η μέγιστη ένταση του ουράνιου τόξου πέφτει υπό γωνία κάπως μεγαλύτερη από την ελάχιστη γωνία σκέδασης του Descartes. Οι θεωρίες Descartes και Young προβλέπουν μια άπειρη ένταση σε αυτή τη γωνία (λόγω της καυστικής). Η θεωρία Airy δεν φτάνει σε άπειρη ένταση σε κανένα σημείο, και στην ακτίνα ουράνιου τόξου του Descartes η προβλεπόμενη ένταση είναι μικρότερη από το μισό της μέγιστης. Τέλος, τα φαινόμενα περίθλασης εμφανίζονται στη σκοτεινή πλευρά του ουράνιου τόξου: αντί να εξαφανίζονται απότομα, η ένταση μειώνεται ομαλά μέσα στη σκοτεινή ζώνη του Alexander.
Οι υπολογισμοί του Airy αφορούσαν ένα μονοχρωματικό ουράνιο τόξο. Για να εφαρμοστεί η μέθοδός του σε ένα ουράνιο τόξο που παράγεται στο ηλιακό φως, πρέπει να υπερτεθούν τα μοτίβα Airy που παράγονται από τα διάφορα μονοχρωματικά συστατικά. Για να προχωρήσουμε περαιτέρω και να περιγράψουμε την αντιληπτή εικόνα του ουράνιου τόξου απαιτείται μια θεωρία της χρωματικής όρασης.
Η καθαρότητα των χρωμάτων του ουράνιου τόξου καθορίζεται από το βαθμό στον οποίο τα συστατικά μονοχρωματικά ουράνια τόξα επικαλύπτονται. Αυτό με τη σειρά του καθορίζεται από το μέγεθος της σταγόνας. Οι ομοιόμορφα μεγάλες σταγόνες (με διαμέτρους της τάξης των μερικών χιλιοστών) γενικά δίνουν φωτεινά ουράνια τόξα με καθαρά χρώματα. Με πολύ μικρές σταγόνες (διαμέτρου περίπου 0,01 χιλιοστών) η επικάλυψη των χρωμάτων είναι τόσο μεγάλη που το προκύπτον φως φαίνεται σχεδόν λευκό.
Μια σημαντική ιδιότητα του φωτός που μέχρι στιγμής έχουμε αγνοήσει είναι η κατάσταση πόλωσής του. Το φως είναι ένα εγκάρσιο κύμα, δηλαδή ένα κύμα στο οποίο οι ταλαντώσεις είναι κάθετες στην κατεύθυνση διάδοσης. (Ο ήχος, από την άλλη πλευρά, είναι μια διαμήκης δόνηση.) Ο προσανατολισμός της εγκάρσιας ταλάντωσης μπορεί να αναλυθεί σε συνιστώσες κατά μήκος δύο αμοιβαία κάθετων αξόνων. Οποιαδήποτε ακτίνα φωτός μπορεί να περιγραφεί με βάση αυτές τις δύο ανεξάρτητες καταστάσεις γραμμικής πόλωσης. Το ηλιακό φως είναι ένα ασυνάρτητο μείγμα των δύο σε ίσες αναλογίες. Συχνά λέγεται ότι είναι τυχαία πολωμένο ή απλώς μη πολωμένο. Η ανάκλαση μπορεί να αλλάξει την κατάσταση πόλωσης, και σε αυτό το γεγονός έγκειται η σημασία της πόλωσης για την ανάλυση του ουράνιου τόξου.
Ας εξετάσουμε την ανάκλαση μιας ακτίνας φωτός που ταξιδεύει μέσα σε μια σταγόνα νερού όταν φτάνει στο όριο της σταγόνας. Το επίπεδο ανάκλασης, το επίπεδο που περιέχει τόσο τις προσπίπτουσες όσο και τις ανακλώμενες ακτίνες, παρέχει μια βολική γεωμετρική αναφορά. Οι καταστάσεις πόλωσης του προσπίπτοντος φωτός μπορούν να οριστούν ως παράλληλες προς αυτό το επίπεδο και κάθετες προς αυτό. Και για τις δύο πολώσεις, η ανακλαστικότητα της επιφάνειας είναι μικρή σε γωνίες πρόσπτωσης κοντά στην κάθετο, και αυξάνεται πολύ απότομα κοντά σε μια κρίσιμη γωνία της οποίας η τιμή καθορίζεται από τον δείκτη διάθλασης. Πέρα από αυτήν την κρίσιμη γωνία, η ακτίνα ανακλάται πλήρως, ανεξάρτητα από την πόλωση. Σε ενδιάμεσες γωνίες, ωστόσο, η ανακλαστικότητα εξαρτάται από την πόλωση. Καθώς η γωνία πρόσπτωσης γίνεται πιο ρηχή, ένα σταθερά μεγαλύτερο μέρος της κάθετα πολωμένης συνιστώσας ανακλάται. Για την παράλληλη συνιστώσα, από την άλλη πλευρά, η ανακλαστικότητα μειώνεται πριν αρχίσει να αυξάνεται. Σε μια συγκεκριμένη γωνία, η ανακλαστικότητα για το παράλληλα πολωμένο κύμα εξαφανίζεται εντελώς. Αυτό το κύμα μεταδίδεται πλήρως. Επομένως, για το ηλιακό φως που προσπίπτει υπό αυτή τη γωνία, η εσωτερικά ανακλώμενη ακτίνα είναι πλήρως πολωμένη κάθετα στο επίπεδο ανάκλασης. Η γωνία ονομάζεται γωνία Brewster, από τον David Brewster, ο οποίος συζήτησε τη σημασία της το 1815.
Το φως από το ουράνιο τόξο είναι σχεδόν πλήρως πολωμένο, όπως μπορεί να φανεί κοιτάζοντας ένα ουράνιο τόξο μέσα από γυαλιά ηλίου Polaroid και περιστρέφοντας τους φακούς γύρω από τη γραμμή όρασης. Η ισχυρή πόλωση προκύπτει από μια αξιοσημείωτη σύμπτωση: η εσωτερική γωνία πρόσπτωσης για την ακτίνα ουράνιου τόξου είναι πολύ κοντά στη γωνία Brewster. Το μεγαλύτερο μέρος της παράλληλης συνιστώσας διαφεύγει στις διερχόμενες ακτίνες της Κλάσης 2, αφήνοντας μια υπεροχή κάθετων ακτίνων στο ουράνιο τόξο.
Με την κατανόηση ότι τόσο η ύλη όσο και η ακτινοβολία μπορούν να συμπεριφερθούν ως κύματα, η θεωρία του ουράνιου τόξου έχει διευρυνθεί σε πεδίο εφαρμογής. Πρέπει τώρα να περιλαμβάνει νέα, αόρατα ουράνια τόξα που παράγονται στην ατομική και πυρηνική σκέδαση.
Μια αναλογία μεταξύ της γεωμετρικής οπτικής και της κλασικής μηχανικής σωματιδίων είχε ήδη γίνει αντιληπτή το 1831 από τον William Rowan Hamilton, τον Ιρλανδό μαθηματικό. Τα ανάλογα των ακτίνων στη γεωμετρική οπτική είναι οι τροχιές των σωματιδίων, και η κάμψη μιας ακτίνας φωτός κατά την είσοδό της σε ένα μέσο με διαφορετικό δείκτη διάθλασης αντιστοιχεί στην εκτροπή ενός κινούμενου σωματιδίου υπό την επίδραση μιας δύναμης. Ανάλογα σκέδασης σωματιδίων υπάρχουν για πολλά φαινόμενα στην οπτική, συμπεριλαμβανομένου του ουράνιου τόξου.
Σκεφτείτε μια σύγκρουση μεταξύ δύο ατόμων σε ένα αέριο. Καθώς τα άτομα πλησιάζουν από μια μεγάλη αρχική απόσταση, αρχικά υπόκεινται σε μια σταθερά αυξανόμενη έλξη. Σε μικρότερη απόσταση, ωστόσο, τα ηλεκτρονιακά στρώματα των ατόμων αρχίζουν να αλληλοδιεισδύουν και η ελκτική δύναμη μειώνεται. Σε πολύ κοντινή απόσταση γίνεται μια ολοένα και πιο ισχυρή άπωση.
Όπως και στο οπτικό πείραμα, η ατομική σκέδαση μπορεί να αναλυθεί με την ανίχνευση των τροχιών των ατόμων ως συνάρτηση της παραμέτρου πρόσκρουσης. Επειδή οι δυνάμεις μεταβάλλονται σταδιακά και συνεχώς, τα άτομα ακολουθούν καμπύλες τροχιές αντί να αλλάζουν κατεύθυνση ξαφνικά, όπως στα όρια μεταξύ μέσων με διαφορετικό δείκτη διάθλασης. Παρόλο που ορισμένες από τις τροχιές είναι μάλλον περίπλοκες, κάθε παράμετρος πρόσκρουσης αντιστοιχεί σε μία μόνο γωνία εκτροπής: επιπλέον, υπάρχει μία τροχιά που αντιπροσωπεύει μια τοπική μέγιστη γωνιακή εκτροπή. Αυτή η τροχιά αποδεικνύεται ότι είναι αυτή που κάνει την πιο αποτελεσματική χρήση της ελκτικής αλληλεπίδρασης μεταξύ των ατόμων. Αναμένεται ισχυρή συγκέντρωση σκεδασμένων σωματιδίων κοντά σε αυτή τη γωνία. Είναι η γωνία του ουράνιου τόξου για τα αλληλεπιδρώντα άτομα.


Εικόνα: Η ΠΟΛΩΣΗ ΤΟΥ ΟΥΡΑΝΙΟΥ ΤΟΞΟΥ προκύπτει από διαφορική ανάκλαση. Μια προσπίπτουσα ακτίνα μπορεί να αναλυθεί σε δύο συνιστώσες πολωμένες παράλληλα και κάθετα στο επίπεδο ανάκλασης. Για μια ακτίνα που πλησιάζει ένα όριο αέρα-νερού από το εσωτερικό μιας σταγόνας, η ανακλαστικότητα της επιφάνειας εξαρτάται από τη γωνία πρόσπτωσης. Πέρα από μια κρίσιμη γωνία, τόσο οι παράλληλες όσο και οι κάθετες συνιστώσες ανακλώνται πλήρως, αν και κάποιο φως ταξιδεύει παράλληλα με την επιφάνεια ως «φευγαλέο κύμα». Σε μικρότερες γωνίες, η κάθετη συνιστώσα ανακλάται πιο αποτελεσματικά από την παράλληλη, και σε μια συγκεκριμένη γωνία, στη γωνία Brewster, το παράλληλα πολωμένο φως μεταδίδεται πλήρως. Η γωνία εσωτερικής ανάκλασης για την ακτίνα του ουράνιου τόξου πέφτει κοντά στη γωνία Brewster. Ως αποτέλεσμα, το φως από το ουράνιο τόξο έχει ισχυρή κάθετη πόλωση.
Μια κυματομηχανική επεξεργασία των ατομικών και πυρηνικών ουράνιων τόξων διατυπώθηκε το 1959 από τον Kenneth W. Ford του Πανεπιστημίου Brandeis και τον John A. Wheeler του Πανεπιστημίου του Princeton. Η συμβολή μεταξύ τροχιών που αναδύονται στην ίδια κατεύθυνση δημιουργεί υπεράριθμες κορυφές έντασης. Έχει επίσης προκύψει ένα ανάλογο σκέδασης σωματιδίων της θεωρίας του Airy.
Ένα ατομικό ουράνιο τόξο παρατηρήθηκε για πρώτη φορά το 1964, από τους E. Hundhausen και H. Pauly του Πανεπιστημίου της Βόννης, στη σκέδαση ατόμων νατρίου από άτομα υδραργύρου. Η κύρια κορυφή του ουράνιου τόξου και δύο υπεράριθμα φαινόμενα ανιχνεύθηκαν. Σε πιο πρόσφατα πειράματα έχουν παρατηρηθεί ταλαντώσεις σε ακόμη λεπτότερη κλίμακα. Τα ουράνια τόξα που μετρήθηκαν σε αυτά τα πειράματα φέρουν πληροφορίες σχετικά με τις διατομικές δυνάμεις. Όπως ακριβώς η οπτική γωνία του ουράνιου τόξου εξαρτάται αποκλειστικά από τον δείκτη διάθλασης, έτσι και η ατομική γωνία του ουράνιου τόξου καθορίζεται από την ισχύ του ελκτικού μέρους της αλληλεπίδρασης. Ομοίως, οι θέσεις των υπεράριθμων κορυφών εξαρτώνται από το μέγεθος και παρέχουν πληροφορίες σχετικά με το εύρος της αλληλεπίδρασης. Παρατηρήσεις του ίδιου είδους έχουν γίνει τώρα στη σκέδαση ατομικών πυρήνων.
 Εικόνα: Η σκέδαση ατόμων από άτομα δημιουργεί ένα σωματιδιακό ουράνιο τόξο. Ο ρόλος που παίζει στην οπτική σκέδαση ο δείκτης διάθλασης παίζεται εδώ από τις διατομικές δυνάμεις. Η κύρια διαφορά είναι ότι οι δυνάμεις μεταβάλλονται ομαλά και συνεχώς, έτσι ώστε τα άτομα να ακολουθούν καμπύλες τροχιές. Καθώς ένα άτομο πλησιάζει ένα άλλο, η δύναμη μεταξύ τους είναι αρχικά μια σταθερά αυξανόμενη έλξη (έγχρωμη σκίαση), αλλά σε κοντινή απόσταση γίνεται έντονα απωστική (γκρίζα σκίαση). Ένα τοπικό μέγιστο στη γωνία σκέδασης αντιστοιχεί στη γωνία οπτικού ουράνιου τόξου. Είναι η γωνία που σχηματίζεται από την τροχιά που χρησιμοποιεί το ελκτικό μέρος του δυναμικού με τον πιο αποτελεσματικό τρόπο.
Εικόνα: Η σκέδαση ατόμων από άτομα δημιουργεί ένα σωματιδιακό ουράνιο τόξο. Ο ρόλος που παίζει στην οπτική σκέδαση ο δείκτης διάθλασης παίζεται εδώ από τις διατομικές δυνάμεις. Η κύρια διαφορά είναι ότι οι δυνάμεις μεταβάλλονται ομαλά και συνεχώς, έτσι ώστε τα άτομα να ακολουθούν καμπύλες τροχιές. Καθώς ένα άτομο πλησιάζει ένα άλλο, η δύναμη μεταξύ τους είναι αρχικά μια σταθερά αυξανόμενη έλξη (έγχρωμη σκίαση), αλλά σε κοντινή απόσταση γίνεται έντονα απωστική (γκρίζα σκίαση). Ένα τοπικό μέγιστο στη γωνία σκέδασης αντιστοιχεί στη γωνία οπτικού ουράνιου τόξου. Είναι η γωνία που σχηματίζεται από την τροχιά που χρησιμοποιεί το ελκτικό μέρος του δυναμικού με τον πιο αποτελεσματικό τρόπο.
Η θεωρία του Airy για το ουράνιο τόξο έχει σημειώσει πολλές ικανοποιητικές επιτυχίες, αλλά περιέχει μια ανησυχητική αβεβαιότητα: την ανάγκη να μαντέψουμε την κατανομή πλάτους κατά μήκος του επιλεγμένου αρχικού μετώπου κύματος. Οι υποθέσεις που χρησιμοποιούνται για να κάνουμε αυτήν την μαντεία είναι εύλογες μόνο για αρκετά μεγάλες σταγόνες βροχής. Σε αυτό το πλαίσιο, το μέγεθος εκφράζεται καλύτερα με όρους μιας «παραμέτρου μεγέθους», που ορίζεται ως ο λόγος της περιφέρειας μιας σταγόνας προς το μήκος κύματος του φωτός. Η παράμετρος μεγέθους ποικίλλει από περίπου 100 σε ομίχλη έως αρκετές χιλιάδες για μεγάλες σταγόνες βροχής. Η προσέγγιση του Airy είναι εύλογη μόνο για σταγόνες με παράμετρο μεγέθους μεγαλύτερη από περίπου 5.000.
Είναι ειρωνικό το γεγονός ότι ένα πρόβλημα τόσο δυσεπίλυτο όσο το ουράνιο τόξο έχει στην πραγματικότητα μια ακριβή λύση, και μάλιστα γνωστή για πολλά χρόνια. Μόλις προτάθηκε η ηλεκτρομαγνητική θεωρία του φωτός από τον James Clerk Maxwell πριν από περίπου έναν αιώνα, κατέστη δυνατό να δοθεί μια ακριβής μαθηματική διατύπωση του προβλήματος του οπτικού ουράνιου τόξου. Αυτό που χρειάζεται είναι ο υπολογισμός της σκέδασης ενός ηλεκτρομαγνητικού επίπεδου κύματος από μια ομογενή σφαίρα. Η λύση σε ένα παρόμοιο αλλά ελαφρώς ευκολότερο πρόβλημα, τη σκέδαση των ηχητικών κυμάτων από μια σφαίρα, συζητήθηκε από διάφορους ερευνητές, κυρίως τον Λόρδο Rayleigh, τον 19ο αιώνα. Η λύση που έλαβαν αποτελούνταν από μια άπειρη σειρά όρων, που ονομάζονται «μερικά κύματα». Μια λύση της ίδιας μορφής βρέθηκε για το ηλεκτρομαγνητικό πρόβλημα το 1908 από τους Gustav Mie και Peter J. W. Debye.
 Εικόνα: Το ΑΤΟΜΙΚΟ ΟΥΡΑΝΙΟ ΤΟΞΟ ανιχνεύθηκε από τους E. Hundhausen και H. Pauly του Πανεπιστημίου της Βόννης στη σκέδαση ατόμων νατρίου από άτομα υδραργύρου. Οι ταλαντώσεις στον αριθμό των σκεδασμένων ατόμων που ανιχνεύονται αντιστοιχούν σε ένα πρωτεύον ουράνιο τόξο και σε δύο υπεράριθμες κορυφές. Ένα ουράνιο τόξο αυτού του είδους ενσωματώνει πληροφορίες σχετικά με την ισχύ και το εύρος των διατομικών δυνάμεων.
Εικόνα: Το ΑΤΟΜΙΚΟ ΟΥΡΑΝΙΟ ΤΟΞΟ ανιχνεύθηκε από τους E. Hundhausen και H. Pauly του Πανεπιστημίου της Βόννης στη σκέδαση ατόμων νατρίου από άτομα υδραργύρου. Οι ταλαντώσεις στον αριθμό των σκεδασμένων ατόμων που ανιχνεύονται αντιστοιχούν σε ένα πρωτεύον ουράνιο τόξο και σε δύο υπεράριθμες κορυφές. Ένα ουράνιο τόξο αυτού του είδους ενσωματώνει πληροφορίες σχετικά με την ισχύ και το εύρος των διατομικών δυνάμεων.
Δεδομένης της ύπαρξης μιας ακριβούς λύσης στο πρόβλημα της σκέδασης, μπορεί να φαίνεται εύκολο να προσδιοριστούν όλα τα χαρακτηριστικά του, συμπεριλαμβανομένου του ακριβούς χαρακτήρα του ουράνιου τόξου. Το πρόβλημα, φυσικά, είναι η ανάγκη να αθροιστεί η σειρά των μερικών κυμάτων, κάθε όρος των οποίων είναι μια μάλλον πολύπλοκη συνάρτηση. Η σειρά μπορεί να περικοπεί για να δώσει μια κατά προσέγγιση λύση, αλλά αυτή η διαδικασία είναι πρακτική μόνο σε ορισμένες περιπτώσεις. Ο αριθμός των όρων που πρέπει να διατηρηθούν είναι της ίδιας τάξης μεγέθους με την παράμετρο μεγέθους. Η σειρά μερικών κυμάτων είναι επομένως εξαιρετικά κατάλληλη για την αντιμετώπιση της σκέδασης Rayleigh, η οποία είναι υπεύθυνη για το μπλε του ουρανού. Σε αυτή την περίπτωση, τα σωματίδια σκέδασης είναι μόρια και είναι πολύ μικρότερα από το μήκος κύματος, έτσι ώστε ένας όρος της σειράς να είναι αρκετός. Για το πρόβλημα του ουράνιου τόξου, πρέπει να ληφθούν υπόψη παράμετροι μεγέθους έως και αρκετές χιλιάδες.
Μια καλή προσέγγιση της λύσης με τη μέθοδο μερικού κύματος θα απαιτούσε την αξιολόγηση του αθροίσματος αρκετών χιλιάδων περίπλοκων όρων. Έχουν εφαρμοστεί υπολογιστές στο έργο, αλλά τα αποτελέσματα είναι ταχέως μεταβαλλόμενες συναρτήσεις της παραμέτρου μεγέθους και της γωνίας σκέδασης, έτσι ώστε η εργασία και το κόστος να γίνονται γρήγορα απαγορευτικά. Εκτός αυτού, ένας υπολογιστής μπορεί να υπολογίσει μόνο αριθμητικές λύσεις. Δεν προσφέρει καμία εικόνα για τη φυσική του ουράνιου τόξου. Βρισκόμαστε έτσι στη δελεαστική κατάσταση να γνωρίζουμε μια μορφή της ακριβούς λύσης και όμως να μην μπορούμε να εξάγουμε από αυτήν μια κατανόηση των φαινομένων που περιγράφει.
Τα πρώτα βήματα προς την επίλυση αυτού του παραδόξου έγιναν στις αρχές του 20ού αιώνα από τους μαθηματικούς Henri Poincare και G. N. Watson. Βρήκαν μια μέθοδο για τον μετασχηματισμό της μερικής κυματοσειράς, η οποία συγκλίνει πολύ αργά σε μια σταθερή τιμή, σε μια ταχέως συγκλίνουσα έκφραση. Η τεχνική έχει γίνει γνωστή ως μετασχηματισμός Watson ή ως μέθοδος σύνθετης γωνιακής ορμής.
Δεν είναι ιδιαίτερα δύσκολο να καταλάβουμε γιατί η γωνιακή ορμή εμπλέκεται στο πρόβλημα του ουράνιου τόξου, αν και είναι λιγότερο προφανές γιατί πρέπει να ληφθούν υπόψη οι «σύνθετες» τιμές της γωνιακής ορμής. Η εξήγηση είναι απλούστερη σε μια σωματιδιακή θεωρία του φωτός, στην οποία μια δέσμη φωτός θεωρείται ως ένα ρεύμα σωματιδίων που ονομάζονται φωτόνια. Παρόλο που το φωτόνιο δεν έχει μάζα, μεταφέρει ενέργεια και ορμή σε αντιστρόφως ανάλογη με το μήκος κύματος του αντίστοιχου φωτεινού κύματος. Όταν ένα φωτόνιο χτυπά μια σταγόνα νερού με κάποια παράμετρο κρούσης μεγαλύτερη από το μηδέν, το φωτόνιο φέρει μια στροφορμή ίση με το γινόμενο της γραμμικής του ορμής και της παραμέτρου κρούσης. Καθώς το φωτόνιο υφίσταται μια σειρά εσωτερικών ανακλάσεων, ουσιαστικά περιστρέφεται γύρω από το κέντρο της σταγόνας. Στην πραγματικότητα, η κβαντομηχανική θέτει πρόσθετους περιορισμούς σε αυτή τη διαδικασία. Αφενός, απαιτεί η στροφορμή να λαμβάνει μόνο ορισμένες διακριτές τιμές· αφετέρου, αρνείται ότι η παράμετρος κρούσης μπορεί να προσδιοριστεί με ακρίβεια. Κάθε διακριτή τιμή της στροφορμής αντιστοιχεί σε έναν όρο στη σειρά μερικών κυμάτων.
Για να εκτελεστεί ο μετασχηματισμός Watson, πρέπει να εισαχθούν τιμές της στροφορμής που συμβατικά θεωρούνται «μη φυσικές». Καταρχάς, η στροφορμή πρέπει να επιτρέπεται να μεταβάλλεται συνεχώς, αντί σε κβαντισμένες μονάδες· Πιο σημαντικό, πρέπει να επιτρέπεται να κυμαίνονται πάνω από τους μιγαδικούς αριθμούς: εκείνους που περιλαμβάνουν τόσο μια πραγματική όσο και μια φανταστική συνιστώσα, που περιέχουν κάποιο πολλαπλάσιο της τετραγωνικής ρίζας του -1. Το επίπεδο που ορίζεται από αυτές τις δύο συνιστώσες αναφέρεται ως επίπεδο μιγαδικής γωνιακής ορμής.
Πολλά κερδίζονται σε αντάλλαγμα για τις μαθηματικές αφαιρέσεις της μεθόδου μιγαδικής γωνιακής ορμής. Συγκεκριμένα, αφού μεταβούμε στο επίπεδο μιγαδικής γωνιακής ορμής μέσω του μετασχηματισμού Watson, οι συνεισφορές στη σειρά μερικού κύματος μπορούν να αναδιανεμηθούν. Αντί για πολλούς όρους, μπορεί κανείς να εργαστεί με λίγα μόνο σημεία που ονομάζονται πόλοι και σημεία σέλας στο επίπεδο μιγαδικής γωνιακής ορμής. Τα τελευταία χρόνια οι πόλοι έχουν προσελκύσει μεγάλο θεωρητικό ενδιαφέρον στη φυσική των στοιχειωδών σωματιδίων. Σε αυτό το πλαίσιο συνήθως ονομάζονται πόλοι Regge, από τον Ιταλό φυσικό Tullio Regge.
 Εικόνα: Η θεωρία της ΠΕΠΛΕΓΜΕΝΗΣ ΓΩΝΙΑΚΗΣ ΟΡΜΗΣ του ουράνιου τόξου ξεκινά με την παρατήρηση ότι ένα φωτόνιο, ή κβάντο φωτός, που προσπίπτει σε μια σταγόνα σε κάποια παράμετρο πρόσκρουσης (η οποία δεν μπορεί να οριστεί με ακρίβεια) φέρει στροφορμή. Στη θεωρία, τα συστατικά αυτής της στροφορμής επεκτείνονται σε μιγαδικές τιμές, δηλαδή, τιμές που περιέχουν την τετραγωνική ρίζα του -1. Οι συνέπειες αυτής της διαδικασίας μπορούν να απεικονιστούν με το παράδειγμα μιας ακτίνας που χτυπά μια σταγόνα εφαπτομενικά. Η ακτίνα διεγείρει επιφανειακά κύματα, τα οποία ταξιδεύουν γύρω από τη σταγόνα και συνεχώς εκπέμπουν ακτινοβολία. Η ακτίνα μπορεί επίσης να διαπεράσει τη σταγόνα στην κρίσιμη γωνία για ολική εσωτερική ανάκλαση, αναδυόμενη είτε για να σχηματίσει ένα άλλο επιφανειακό κύμα είτε για να επαναλάβει τη συντόμευση.
Εικόνα: Η θεωρία της ΠΕΠΛΕΓΜΕΝΗΣ ΓΩΝΙΑΚΗΣ ΟΡΜΗΣ του ουράνιου τόξου ξεκινά με την παρατήρηση ότι ένα φωτόνιο, ή κβάντο φωτός, που προσπίπτει σε μια σταγόνα σε κάποια παράμετρο πρόσκρουσης (η οποία δεν μπορεί να οριστεί με ακρίβεια) φέρει στροφορμή. Στη θεωρία, τα συστατικά αυτής της στροφορμής επεκτείνονται σε μιγαδικές τιμές, δηλαδή, τιμές που περιέχουν την τετραγωνική ρίζα του -1. Οι συνέπειες αυτής της διαδικασίας μπορούν να απεικονιστούν με το παράδειγμα μιας ακτίνας που χτυπά μια σταγόνα εφαπτομενικά. Η ακτίνα διεγείρει επιφανειακά κύματα, τα οποία ταξιδεύουν γύρω από τη σταγόνα και συνεχώς εκπέμπουν ακτινοβολία. Η ακτίνα μπορεί επίσης να διαπεράσει τη σταγόνα στην κρίσιμη γωνία για ολική εσωτερική ανάκλαση, αναδυόμενη είτε για να σχηματίσει ένα άλλο επιφανειακό κύμα είτε για να επαναλάβει τη συντόμευση.
Τόσο οι πόλοι όσο και τα σημεία σέλας έχουν φυσικές ερμηνείες στο πρόβλημα του ουράνιου τόξου. Οι συνεισφορές από πραγματικά σημεία σέλας σχετίζονται με τις συνηθισμένες, πραγματικές ακτίνες φωτός που έχουμε εξετάσει σε όλο αυτό το άρθρο. Τι γίνεται με τα σύνθετα σημεία σέλας; Οι φανταστικοί ή σύνθετοι αριθμοί συνήθως θεωρούνται μη φυσικές λύσεις σε μια εξίσωση, αλλά δεν είναι λύσεις χωρίς νόημα. Στις περιγραφές της διάδοσης κυμάτων, οι φανταστικές συνιστώσες συνήθως σχετίζονται με την απόσβεση του πλάτους του κύματος. Για παράδειγμα, στην ολική εσωτερική ανάκλαση μιας ακτίνας φωτός σε ένα όριο νερού-αέρα, ένα κύμα φωτός περνάει «μέσα από τον καθρέφτη». Το πλάτος του αποσβένεται γρήγορα, ωστόσο, έτσι ώστε η ένταση να γίνεται αμελητέα σε βάθος της τάξης του ενός μόνο μήκους κύματος. Ένα τέτοιο κύμα δεν διαδίδεται στον αέρα. Αντίθετα, προσκολλάται στη διεπαφή μεταξύ του νερού και του αέρα, ταξιδεύοντας κατά μήκος της επιφάνειας. Ονομάζεται εξαφανιζόμενο κύμα. Η μαθηματική περιγραφή του εξαφανιζόμενου κύματος περιλαμβάνει τα φανταστικά συστατικά μιας λύσης. Το φαινόμενο που ονομάζεται κβαντομηχανική σήραγγα,
στο οποίο ένα σωματίδιο διέρχεται από ένα δυναμικό φράγμα χωρίς να το σκαρφαλώσει, έχει παρόμοια μαθηματική βάση. Οι «σύνθετες ακτίνες» εμφανίζονται επίσης στην πλευρά της σκιάς ενός καυστικού, όπου περιγράφουν το αποσβεσμένο πλάτος των διαθλασμένων φωτεινών κυμάτων. Οι συνεισφορές των κανονικών πόλων στη μετασχηματισμένη σειρά μερικών κυμάτων σχετίζονται με επιφανειακά κύματα άλλου είδους.
Αυτά τα κύματα διεγείρονται από προσπίπτουσες ακτίνες που χτυπούν τη σφαίρα εφαπτομενικά. Μόλις εκτοξευθεί ένα τέτοιο κύμα, ταξιδεύει γύρω από τη σφαίρα, αλλά συνεχώς αποσβένεται επειδή αποβάλλει ακτινοβολία εφαπτομενικά, όπως ένα ποτιστικό κήπου. Σε κάθε σημείο κατά μήκος της περιφερειακής διαδρομής του κύματος, διαπερνά επίσης τη σφαίρα στην κρίσιμη γωνία για ολική εσωτερική ανάκλαση, επανεμφανιζόμενο ως επιφανειακό κύμα αφού ακολουθήσει μία ή περισσότερες τέτοιες συντομεύσεις. Είναι ενδιαφέρον να σημειωθεί ότι ο Γιοχάνες Κέπλερ υπέθεσε το 1584 ότι οι ακτίνες αυτού του είδους «τροχού καρφίτσας» μπορεί να ευθύνονται για το ουράνιο τόξο, αλλά εγκατέλειψε την ιδέα επειδή δεν οδηγούσε στη σωστή γωνία του ουράνιου τόξου. Το 1937, οι Ολλανδοί φυσικοί Μπάλθους Βαν ντερ Πολ και Χ. Μπρέμερ εφάρμοσαν τον μετασχηματισμό του Γουάτσον στο πρόβλημα του ουράνιου τόξου, αλλά μπόρεσαν να δείξουν μόνο ότι η προσέγγιση του Αίρυ μπορούσε να ληφθεί ως οριακή περίπτωση. Το 1965 ανέπτυξα μια βελτιωμένη έκδοση της μεθόδου του Γουάτσον και την εφάρμοσα στο πρόβλημα του ουράνιου τόξου το 1969 με κάπως μεγαλύτερη επιτυχία.
 Εικόνα: Οι ΠΟΣΟΤΙΚΕΣ ΘΕΩΡΙΕΣ του ουράνιου τόξου προβλέπουν την ένταση του σκεδαζόμενου φωτός ως συνάρτηση της γωνίας σκέδασης και επίσης σε σχέση με το μέγεθος και την πόλωση των σταγονιδίων. Εδώ παρουσιάζονται οι προβλέψεις τριών θεωριών για παράλληλα πολωμένο φως σκεδαζόμενο από σταγονίδια με περιφέρεια ίση με 1.500 μήκη κύματος του φωτός. Μία καμπύλη αντιπροσωπεύει την «ακριβή» λύση στο πρόβλημα του ουράνιου τόξου, που προέρχεται από τις εξισώσεις του James Clerk Maxwell που περιγράφουν την ηλεκτρομαγνητική ακτινοβολία. Η ακριβής λύση είναι το άθροισμα μιας άπειρης σειράς όρων, που προσεγγίζονται εδώ προσθέτοντας περισσότερους από 1.500 περίπλοκους όρους για κάθε σημείο που χρησιμοποιείται στη σχεδίαση της καμπύλης. Η θεωρία του Airy διαφωνεί σαφώς με την ακριβή λύση, ιδιαίτερα στην γωνιακή περιοχή των υπεράριθμων τόξων. Εκεί η ακριβής λύση δείχνει κοιλότητες στις θέσεις των κορυφών του Airy. Από την άλλη πλευρά, τα αποτελέσματα που λαμβάνονται με τη μέθοδο της μιγαδικής στροφορμής αντιστοιχούν σε μεγάλο βαθμό στην ακριβή λύση, αποτυγχάνοντας μόνο να αναπαράγουν μικρές, υψηλής συχνότητας ταλαντώσεις. Αυτές οι διακυμάνσεις σχετίζονται με ένα άλλο οπτικό φαινόμενο στην ατμόσφαιρα, τη glory, το οποίο εξηγείται επίσης από τη θεωρία της μιγαδικής στροφορμής.
Εικόνα: Οι ΠΟΣΟΤΙΚΕΣ ΘΕΩΡΙΕΣ του ουράνιου τόξου προβλέπουν την ένταση του σκεδαζόμενου φωτός ως συνάρτηση της γωνίας σκέδασης και επίσης σε σχέση με το μέγεθος και την πόλωση των σταγονιδίων. Εδώ παρουσιάζονται οι προβλέψεις τριών θεωριών για παράλληλα πολωμένο φως σκεδαζόμενο από σταγονίδια με περιφέρεια ίση με 1.500 μήκη κύματος του φωτός. Μία καμπύλη αντιπροσωπεύει την «ακριβή» λύση στο πρόβλημα του ουράνιου τόξου, που προέρχεται από τις εξισώσεις του James Clerk Maxwell που περιγράφουν την ηλεκτρομαγνητική ακτινοβολία. Η ακριβής λύση είναι το άθροισμα μιας άπειρης σειράς όρων, που προσεγγίζονται εδώ προσθέτοντας περισσότερους από 1.500 περίπλοκους όρους για κάθε σημείο που χρησιμοποιείται στη σχεδίαση της καμπύλης. Η θεωρία του Airy διαφωνεί σαφώς με την ακριβή λύση, ιδιαίτερα στην γωνιακή περιοχή των υπεράριθμων τόξων. Εκεί η ακριβής λύση δείχνει κοιλότητες στις θέσεις των κορυφών του Airy. Από την άλλη πλευρά, τα αποτελέσματα που λαμβάνονται με τη μέθοδο της μιγαδικής στροφορμής αντιστοιχούν σε μεγάλο βαθμό στην ακριβή λύση, αποτυγχάνοντας μόνο να αναπαράγουν μικρές, υψηλής συχνότητας ταλαντώσεις. Αυτές οι διακυμάνσεις σχετίζονται με ένα άλλο οπτικό φαινόμενο στην ατμόσφαιρα, τη glory, το οποίο εξηγείται επίσης από τη θεωρία της μιγαδικής στροφορμής.
Στην απλή Καρτεσιανή ανάλυση είδαμε ότι στην φωτισμένη πλευρά του ουράνιου τόξου αναδύονται δύο ακτίνες προς την ίδια κατεύθυνση. Στη γωνία του ουράνιου τόξου, αυτές συγχωνεύονται στην ενιαία ακτίνα Ντεκάρτ ελάχιστης εκτροπής και στην πλευρά της σκιάς εξαφανίζονται. Στο επίπεδο της σύνθετης γωνιακής ορμής, όπως έχω αναφέρει, κάθε γεωμετρική ακτίνα αντιστοιχεί σε ένα πραγματικό σημείο σέλας.
Επομένως, με μαθηματικούς όρους, ένα ουράνιο τόξο είναι απλώς η σύγκρουση δύο σημείων σέλας στο επίπεδο της σύνθετης γωνιακής ορμής. Στην περιοχή της σκιάς πέρα από τη γωνία του ουράνιου τόξου, τα σημεία σέλας δεν εξαφανίζονται απλώς. Γίνονται σύνθετα, δηλαδή, αναπτύσσουν φανταστικά μέρη. Το διαθλασμένο φως στη σκοτεινή ζώνη του Αλεξάνδρου προέρχεται από ένα σύνθετο σημείο σέλας. Είναι ένα παράδειγμα μιας «σύνθετης ακτίνας» στην πλευρά της σκιάς μιας καυστικής καμπύλης. Θα πρέπει να σημειωθεί ότι η υιοθέτηση της μεθόδου μιγαδικής γωνιακής ορμής δεν υπονοεί ότι οι προηγούμενες λύσεις στο πρόβλημα του ουράνιου τόξου ήταν λανθασμένες.
Η εξήγηση του Ντεκάρτ για το πρωτεύον τόξο ως την ακτίνα ελάχιστης εκτροπής δεν είναι σε καμία περίπτωση άκυρη και τα υπεράριθμα τόξα μπορούν ακόμα να θεωρηθούν ως ένα προϊόν συμβολής, όπως πρότεινε ο Γιανγκ. Η μέθοδος μιγαδικής γωνιακής ορμής απλώς δίνει μια πιο ολοκληρωμένη καταγραφή των διαδρομών που είναι διαθέσιμες σε ένα φωτόνιο στην περιοχή του ουράνιου τόξου του ουρανού και έτσι επιτυγχάνει πιο ακριβή αποτελέσματα.
Το 1975, ο Βιτζάι Κάρε του Πανεπιστημίου του Ρότσεστερ έκανε μια λεπτομερή σύγκριση τριών θεωριών του ουράνιου τόξου: την προσέγγιση Airy, την «ακριβή» λύση, που λαμβάνεται με άθροιση σε υπολογιστή της σειράς μερικών κυμάτων, και τους όρους του ουράνιου τόξου στη μέθοδο μιγαδικής γωνιακής ορμής, που σχετίζονται με τη σύγκρουση δύο σημείων σέλας. Για την «κυρίαρχη, κάθετη πόλωση», η θεωρία Airy απαιτεί μόνο μικρές διορθώσεις εντός του πρωτεύοντος τόξου και τα «σφάλματά» της γίνονται αισθητά μόνο στην «περιοχή των υπεράριθμων τόξων». Για τις σκεδαζόμενες ακτίνες που είναι πολωμένες παράλληλα προς το «επίπεδο σκέδασης», ωστόσο, η προσέγγιση του Airy αποτυγχάνει παταγωδώς. Για τα υπεράριθμα τόξα, η ακριβής λύση δείχνει «ελάχιστα όπου η θεωρία Airy έχει μέγιστη ένταση και αντίστροφα. Αυτή η σοβαρή αποτυχία είναι ένα έμμεσο αποτέλεσμα της «σχεδόν σύμπτωσης» μεταξύ της γωνίας «εσωτερικής ανάκλασης για τις ακτίνες ουράνιου τόξου» και της γωνίας Brewster. Στη γωνία Brewster, το πλάτος της ανακλώμενης ακτίνας «αλλάζει πρόσημο», μια αλλαγή που η θεωρία Airy «δεν λαμβάνει υπόψη». Ως αποτέλεσμα της «αλλαγής στο πρόσημο», η συμβολή κατά μήκος των «κατευθύνσεων που αντιστοιχούν στις κορυφές στις λύσεις Airy είναι καταστροφική αντί για εποικοδομητική.
Όσον αφορά τα χαρακτηριστικά μεγάλης κλίμακας, όπως το πρωτεύον τόξο, τα υπεράριθμα τόξα και το μοτίβο περίθλασης της σκοτεινής πλευράς, το αποτέλεσμα της σύνθετης στροφορμής συμφωνεί αρκετά στενά με την ακριβή λύση. Οι διακυμάνσεις μικρότερης κλίμακας στην ακριβή καμπύλη έντασης δεν αναπαράγονται τόσο καλά από τους όρους του ουράνιου τόξου στη μέθοδο της σύνθετης στροφορμής. Από την άλλη πλευρά, η ακριβής λύση, για μια τυπική παράμετρο μεγέθους 1.500, απαιτεί το άθροισμα περισσότερων από 1.500 σύνθετων όρων. Η καμπύλη της σύνθετης στροφορμής λαμβάνεται μόνο από λίγους πολύ απλούστερους όρους.
Οι μικρές υπολειμματικές διακυμάνσεις στην ακριβή καμπύλη έντασης προκύπτουν από εσωτερικές ανακλάσεις ανώτερης τάξης: ακτίνες που ανήκουν σε κλάσεις υψηλότερες από την Κλάση 3 ή την Κλάση 4. Έχουν μικρή σημασία για το πρωτεύον τόξο, αλλά σε μεγαλύτερες γωνίες σκέδασης η συμβολή τους αυξάνεται και κοντά στην αντίστροφη κατεύθυνση γίνεται κυρίαρχη. Εκεί, αυτές οι ακτίνες είναι υπεύθυνες για μια άλλη συναρπαστική μετεωρολογική επίδειξη: τη δόξα [βλ. το άρθρο «Η Δόξα», των Howard C. Bryant και Nelson Jarmie, που αρχίζει στην επόμενη σελίδα].
Η δόξα εμφανίζεται ως ένα φωτοστέφανο φασματικών χρωμάτων που περιβάλλει τη σκιά που ρίχνει ένας παρατηρητής στα σύννεφα ή την ομίχλη. Συνήθως φαίνεται από ένα αεροπλάνο που πετάει πάνω από τα σύννεφα. Μπορεί επίσης να εξηγηθεί μέσω της θεωρίας της σύνθετης γωνιακής ορμής, αλλά η εξήγηση είναι πιο περίπλοκη από αυτή του ουράνιου τόξου. Ένα σύνολο συνεισφορών στη δόξα προέρχεται από τα επιφανειακά κύματα που περιγράφονται από τους πόλους Regge, οι οποίοι σχετίζονται με τις εφαπτομενικές ακτίνες τύπου «ανεμοστρόβιλου» του Kepler. Πολλαπλές εσωτερικές ανακλάσεις που τυχαίνει να παράγουν κλειστά, «αστεροειδή πολύγωνα» παίζουν σημαντικό ρόλο, οδηγώντας σε συντονισμούς ή ενισχύσεις στην ένταση. Τέτοιες γεωμετρικές συμπτώσεις είναι σε μεγάλο βαθμό στο πνεύμα των θεωριών του Kepler.
Ένα δεύτερο σημαντικό σύνολο συνεισφορών, που αποδεικνύεται από τον Khare, προέρχεται από την πλευρά της σκιάς των ουράνιων τόξων ανώτερης τάξης που εμφανίζονται κοντά στην αντίστροφη κατεύθυνση. Αυτές οι συνεισφορές αντιπροσωπεύουν την επίδραση των σύνθετων ακτίνων. Το ουράνιο τόξο 10ης τάξης, που σχηματίζεται μόνο λίγες μοίρες μακριά από την αντίστροφη κατεύθυνση, είναι ιδιαίτερα αποτελεσματικό.
Για τα ουράνια τόξα ανώτερης τάξης, η θεωρία του Airy θα έδινε λανθασμένα αποτελέσματα και για τις δύο πολώσεις, και έτσι πρέπει να χρησιμοποιηθεί η θεωρία της σύνθετης γωνιακής ορμής. Θα μπορούσε κανείς να πει έτσι ότι η δόξα σχηματίζεται εν μέρει από τη σκιά ενός ουράνιου τόξου. Είναι ικανοποιητικό να ανακαλύπτουμε στην κομψή αλλά φαινομενικά αφηρημένη θεωρία της σύνθετης γωνιακής ορμής μια εξήγηση για αυτά τα δύο φυσικά φαινόμενα και να βρίσκουμε εκεί μια απροσδόκητη σύνδεση μεταξύ τους.





























