Μια παρανόηση
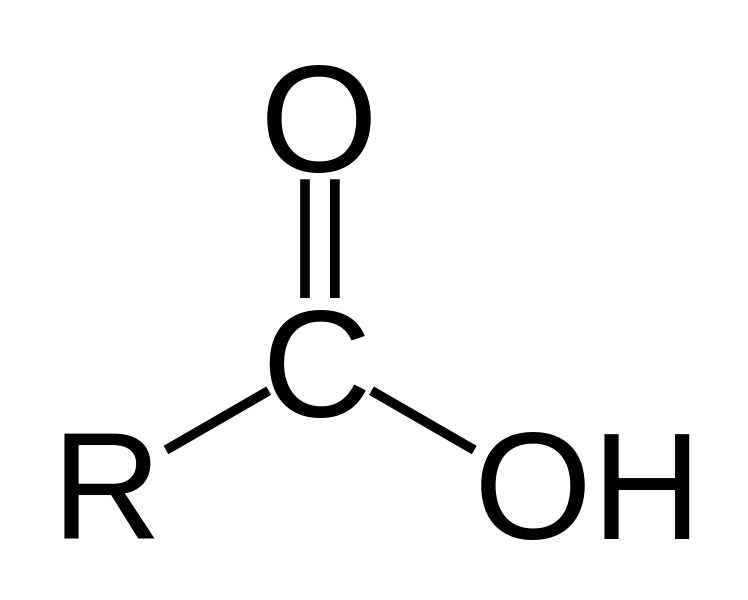
Πολλοί μαθητές παρατηρώντας τον πλήρη συντακτικό τύπο του καρβοξυλίου στα καρβοξυλικά οξέα μπαίνουν στον πειρασμό να ερμηνεύσουν τη δομή του ως μια καρβονυλική ομάδα συνδεδεμένη με ένα υδροξύλιο.
Έτσι πολλοί μαθητές αναρωτιούνται γιατί ένα καρβοξυλικό οξύ δεν έχει τις ιδιότητες μιας κετόνης, μιας αλδεΰδης και μιας αλκοόλης μαζί. Για παράδειγμα αν ίσχυε αυτή η αντίληψη θα μπορούσαν τα οργανικά οξέα να δίνουν αντιδράσεις προσθήκης στο καρβονύλιο, κάτι που δεν ισχύει.
Όξινο υδρογόνο και Ι επαγωγικό φαινόμενο.
Ο όξινος χαρακτήρας των οργανικών οξέων οφείλεται τελικά στο ότι σε υδατικά διαλύματα αποδεσμεύεται το υδρογόνου του “υδροξυλίου” που φαίνεται να βρίσκεται μέσα στο καρβοξύλιο. Γνωρίζουμε ότι το ίδιο ακριβώς συμβαίνει και στις αλκοόλες. Αλλά στις αλκοόλες το υδρογόνο επανασυνδέεται γρήγορα με το οξυγόνο και έτσι η σταθερά ιοντισμού των αλκοολών είναι μικρότερη από τη σταθερά αυτο-ιοντισμού του νερού με αποτέλεσμα οι αλκοόλες να μην παρουσιάζουν όξινες ιδιότητες όταν διαλύονται στο νερό. Λόγω της ύπαρξης του οξυγόνου στο “καρβονύλιο” του καρβοξυλίου το -Ι επαγωγικό φαινόμενο θα περίμενε κανείς να βοηθά το υδρογόνο να αποδεσμευθεί πιο εύκολα. Ακόμη και έτσι η επανασύνδεση του υδρογόνου θα συνέβαινε τόσο γρήγορα που δε δικαιολογείται μία τόσο μεγάλη σταθερά ιοντισμού ![]() .
.
Συντονισμός και απεντοπισμένα ηλεκτρόνια
Τι δίνει λοιπόν τον όξινο χαρακτήρα στα καρβοξυλικά ιόντα; Στο βιβλίο της Χημείας Β΄ Λυκείου στο κεφάλαιο 1.7 Αρωματικές ενώσεις – Βενζόλιο γίνεται αναφορά στη δομή του βενζολίου. Συγκεκριμένα αναφέρει:
Τη λύση στη δομή του βενζολίου έδωσε ο Kekule. Σύμφωνα με τη θεωρία του, τα 6 άτομα άνθρακα συνδέονται μεταξύ τους με τρεις διπλούς και τρεις απλούς δεσμούς, που δε μένουν σε σταθερές θέσεις αλλά εναλλάσσονται, σχηματίζοντας έτσι ένα εξαμελή κυκλικό δακτύλιο, σύμφωνα με το σχήμα:
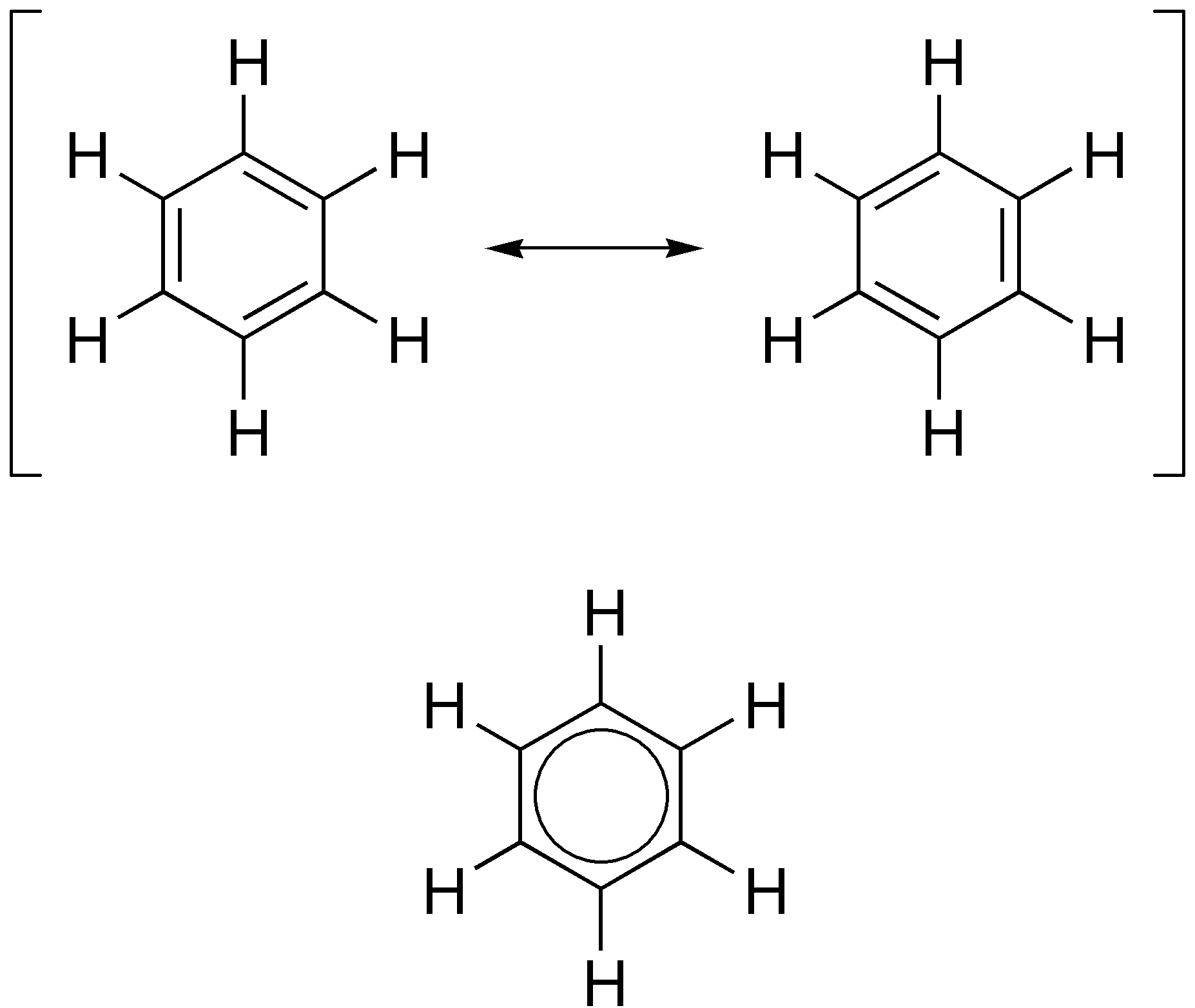
Σήμερα, σύμφωνα με νεώτερες αντιλήψεις, θεωρούμε ότι,
• τα άτομα του άνθρακα του βενζολίου συνδέονται μεταξύ τους ανά δύο με τον ίδιο τρόπο που δεν είναι ούτε απλός ούτε διπλός δεσμός. Ο δεσμός αυτός είναι δηλαδή ένας ενδιάμεσος δεσμός μεταξύ αυτού του απλού και διπλού δεσμού και γι’ αυτό το μόριο του βενζολίου συμβολίζεται:
Κάτι παρόμοιο συμβαίνει και με τα δύο οξυγόνα που απομένουν αφού αποδεσμευτεί για λίγο το υδρογόνο. Το ηλεκτρόνιο του διπλού δεσμού δεν εντοπίζεται στο ένα μόνο οξυγόνο. Πότε εμφανίζεται στο ένα οξυγόνο και πότε στο άλλο. Έτσι το καρβοξυλοανιόν ταλαντώνεται μεταξύ δύο μορφών και το αποτέλεσμα είναι ένας συντονισμός που εμφανίζει μεγάλη χημική σταθερότητα. Η σταθερότητα αυτή εμποδίζει το υδρογόνο να επανασυνδεθεί και έτσι αυξάνεται το ![]() του διαλύματος.
του διαλύματος.

Για περισσότερες λεπτομέρειες βλ. παρακάτω.