ΥΓΡΗ ΚΑΤΑΣΤΑΣΗ – ΤΑΣΗ ΑΤΜΩΝ ΥΓΡΟΥ – ΣΥΓΚΕΝΤΡΩΣΗ ΔΙΑΛΥΜΑΤΟΣ & ΤΡΟΠΟΙ ΔΙΑΤΥΠΩΣΗΣ ΤΗΣ ΣΥΓΚΕΝΤΡΩΣΗΣ – ΔΙΑΛΥΤΟΤΗΤΑ ΑΕΡΙΩΝ ΣΤΑ ΥΓΡΑ & O ΝΟΜΟΣ HENRY
Συγγραφέας: ΗΛΙΑΣ ΓΑΒΡΙΛΗΣ στις 25 Νοεμβρίου 2024
Ονομάζουμε στερεά κατάσταση εκείνη κατά την οποία ένα σώμα έχει σταθερό όγκο και σχήμα, υγρή κατάσταση αυτή κατά την οποία ένα σώμα έχει σταθερό όγκο αλλά όχι σταθερό σχήμα, και τέλος αέρια κατάσταση αυτή κατά την οποία ένα σώμα δεν έχει ούτε σταθερό όγκο, ούτε σταθερό σχήμα. Από τις τρεις καταστάσεις, η αέρια είναι αυτή που μπορεί να μελετηθεί ευκολότερα όπως φαίνεται από τους απλούς νόμους των αερίων, που θεμελιώθηκαν στα πρώτα στάδια ανάπτυξης των θετικών επιστημών, κατά τους νεότερους χρόνους. Η υγρή κατάσταση μελετήθηκε πολύ αργότερα και, μπορεί να πει κανείς ότι η μελέτη της στερεάς κατάστασης βρίσκεται σε πλήρη ανάπτυξη στη σημερινή εποχή.
Στην αέρια κατάσταση οι διαμοριακές ελκτικές δυνάμεις δεν είναι αρκετά ισχυρές για να κρατήσουν τα μόρια του αερίου σε κατάσταση συσσωμάτωσης, δηλαδή πολύ κοντά το ένα στο άλλο. Μπορεί να πει κανείς ότι στην αέρια κατάσταση, οι διαμοριακές ελκτικές δυνάμεις είναι ασθενέστερες από τις αντίστοιχες δυνάμεις απομάκρυνσης που προκύπτουν από τη μοριακή κίνηση. Αντίθετα στην υγρή κατάσταση τα δύο αυτά είδη δυνάμεων είναι περίπου ίσα, ενώ στη στερεή κατάσταση οι διαμοριακές ελκτικές δυνάμεις είναι ισχυρότερες από τις δυνάμεις απομάκρυνσης. Στην υγρή κατάσταση η μεταφορική κίνηση των μορίων (translation) είναι σχετικά εύκολη, γι’ αυτό χαρακτηριστικό της υγρής κατάστασης είναι τα φαινόμενα της διαλυτότητας καθώς και της διάχυσης διαφόρων ουσιών με αποτέλεσμα τον τελικό σχηματισμό ενός ομοιογενούς διαλύματος. Ένα άλλο χαρακτηριστικό της υγρής κατάστασης είναι το ιξώδες (viscosity), το οποίο μπορεί να θεωρηθεί ότι είναι η αντίσταση στη ροή του υγρού.
“Διάλυμα” είναι ένα σύστημα που αποτελείται από διαφορετικές ουσίες, και το οποίο έχει ίδια σύσταση σε κάθε τμήμα της μάζας του. Έτσι τα διαλύματα μπορεί να είναι αέρια, υγρά ή στερεά (Daniels & Alberty 1955). Διακρίνουμε την κύρια ουσία του διαλύματος, το διαλύτη, και τη διαλυμένη ουσία του διαλύματος το διαλυτό (solute).
Ως γνωστόν η έννοια του γραμμοϊσοδυνάμου (gram equivalent – eq) διατυπώθηκε πολύ πριν από αυτήν του γραμμομορίου (gram molecule – mole). Διακρίνουμε την κύρια ουσία του διαλύματος, το διαλύτη, και τη διαλυμένη ουσία του διαλύματος το διαλυτό (solute). Και οι δύο αυτές έννοιες είναι ιδιαίτερα χρήσιμες γιατί μας δίνουν πληροφορίες για την ικανότητα αντίδρασης μιας ποσότητας ουσίας με μια ποσότητα άλλης ουσίας (γραμμοϊσοδύναμο), ή για τον αριθμό των διακριτών μονάδων (μορίων ή ιόντων) οι οποίες βρίσκονται σε μια ποσότητα ουσίας (γραμμομόριο – mole). Όταν μιλάμε για ένα διάλυμα (υγρού μέσα σε υγρό, ή στερεού μέσα σε υγρό) επιδιώκουμε να έχουμε όσο γίνεται περισσότερες πληροφορίες για τη σύσταση του διαλύματος, όμως ταυτόχρονα επιδιώκουμε να έχουμε όσο γίνεται μεγαλύτερη ευκολία στη διατύπωσή μας. Έτσι κανείς, όσο σχολαστικός επιστήμων και να είναι, “δεν θα διατυπώσει σε Angstrom (Ao) το μήκος ενός υφάσματος που το αγοράζει για να κάμει με αυτό ένα κοστούμι” (Schrondinger 1967). Ο τρόπος με τον οποίο ονομάζουμε ένα διάλυμα καθορίζεται κυρίως από τη χρήση για την οποία προορίζουμε το διάλυμα αυτό. Οι κυριότεροι τρόποι περιγραφής της σύνθεσης ενός διαλύματος είναι οι παρακάτω:
- Επί τοις εκατό όγκο σε όγκο – % (v/v). Ένα υδατικό διάλυμα αιθανόλης 70 % (v/v) αποτελείται από 70 όγκους αιθανόλης σε 100 όγκους διαλύματος. Για παράδειγμα ένα αλκοολούχο ποτό 5 αλκοολικών βαθμών (μπύρα alc 5o) είναι 5 % (v/v), που σημαίνει ότι σε κάθε 100 ml ποτού υπάρχουν 5 ml αιθανόλης.
- Επι τοις εκατό κατά βάρος (w/w). Ένα υδατικό διάλυμα γλυκόζης 10 % (w/w) αποτελείται από 10 μονάδες βάρους γλυκόζης και 90 μονάδες βάρους νερού.
- Επί τοις εκατό βάρους σε όγκο (w/v). Για παράδειγμα ένα διάλυμα γλυκόζης 2 % (w/v) αποτελείται από 2 g γλυκόζης σε κάθε 100 ml διαλύματος.
- Η Μοριακότητα κατ’ όγκο – Molarity – του διαλύματος, δηλαδή ο αριθμός των moles της ουσίας που είναι διαλυμένα σε ένα λίτρο (1 L) διαλύματος. Η Molarity γράφεται είτε με το κεφαλαίο γράμμα Μ (πχ 0,5 Μ), είτε με την πλήρη ονομασία (0,5 moles per liter – 0,5 mole/L). Οι υποδιαιρέσεις της Molarity είναι χιλιοστομοριακότητα (mM) και μικρομοριακότητα (μM). Ένα χιλιοστομοριακό διάλυμα γράφεται: 10-3Μ ή mM, ενώ ένα μικρομοριακό διάλυμα γράφεται: 10-6Μ ή μM. Ένα διάλυμα γλυκόζης 180 g/L είναι διάλυμα 1 M ή 1 mole L-1. Ένα διάλυμα γλυκόζης 0,09 % (w/w), είναι διάλυμα 0,005 Μ ή 5,000 μΜ (Mr ΓΛΥΚΟΖΗΣ = 180).
- Μοριακότητα κατά βάρος – molality – είναι ο αριθμός των moles μιας ουσίας που έχουν διαλυθεί σε 1000 g διαλύτη. Η Μοριακότητα κατά βάρος γράφεται με το μικρό γράμμα m. Ένα διάλυμα στο οποίο 180 g γλυκόζης είναι διαλυμένα σε 1000 g νερού, είναι διάλυμα 1 m (1 molar). Η διατύπωση της συγκέντρωσης ενός διαλύματος με μορφή molality, έχει το πλεονέκτημα ότι η τελευταία δεν μεταβάλλεται με την αλλαγή της θερμοκρασίας.
- Το γραμμομοριακό κλάσμα ορίζεται ως εξής: Εάν ο αριθμός των moles μιας διαλυμένης ουσίας A είναι na, ενώ τα moles του διαλύτη και όλων των άλλων ουσιών είναι nb, nc, nd κλπ, τότε το γραμμομοριακό κλάσμα (xa της διαλυμένης ουσίας A στο διάλυμα είναι ίσο με: xA = nA/(nA+ nB + nC + nD+…).
Παράδειγμα: Εάν ένα διάλυμα περιέχει 60 g (1 mole) οξικού οξέος και 1000 g νερού, τότε το γραμμομοριακό κλάσμα x του οξικού οξέος είναι:
x = 1/(1+55,5) = 0,0177
Είναι ευνόητο ότι, για το παραπάνω διάλυμα, το γραμμομοριακό κλάσμα του νερού είναι 0,983. (Η molarity του νερού είναι 1000/18=55,5 Μ).
7. Η διατύπωση της συγκέντρωσης σε ισοδύναμα (eq) και τις υποδιαιρέσεις τους. Ονομάζουμε γραμμοϊσοδύναμο (gram equivalent g-eq), ή για συντομία ισοδύναμο (equivalent) μιας ένωσης, την ποσότητα της ένωσης αυτής που περιέχει ή αποδίδει σε διάλυμα ή αντίδραση 1 mole στοιχειωδών φορτίων Q = NAx [e–] = 96489 Coulomb όπουNA ο αριθμός Avogadro. Έτσι επειδή 1 mole CaCl2 περιέχει 2 mole στοιχειωδών φορτίων το 1 eqCaCl2 = 1 mole/2 = 111/2 = 55,5 g. Η περιεκτικότητα ενός διαλύματος που αντιστοιχεί σε 1 ισοδύναμο ανά λίτρο γράφεται 1 eq/L (eq . L-1), και ένα διάλυμα που περιέχει ένα χιλιοστοισοδύναμο (1/1000 eq) ανά λίτρο γράφεται 1 meq/L (meq . L-1).
Η εξάτμιση ενός υγρού και η τάση ατμών του υγρού: Η μετάπτωση ενός σώματος από την υγρή στην αέριο κατάσταση ονομάζεται εξάτμιση του υγρού (για ένα στερεό σώμα το αντίστοιχο φαινόμενο ονομάζεται εξάχνωση). Το αντίθετο φαινόμενο, ο σχηματισμός υγρού από αέριο, ονομάζεται συμπύκνωση του αερίου. Οι δύο αυτές διεργασίες, εξάτμιση και συμπύκνωση, γίνονται ταυτόχρονα, όταν δε οι ταχύτητες των διεργασιών εξισωθούν, τότε έχει επέλθει μια κατάσταση ισορροπίας ανάμεσα στην υγρή και την αέρια φάση ενός σώματος.
Η τάση ατμών ενός υγρού, ο ατμός του οποίου βρίσκεται σε ισορροπία με το υγρό, ορίζεται σαν η πίεση που ασκείται στα τοιχώματα του δοχείου, καθώς και στην επιφάνεια του υγρού από τον ατμό. Τα φαινόμενα της εξάτμισης και της συμπύκνωσης εξηγούνται με την κινητική θεωρία. Για την ιδανική κατάσταση, η σχέση ανάμεσα στην τάση ατμών ενός υγρού και την απόλυτη θερμοκρασία δίνεται από την εξίσωση Clausius-Clapeyron:
ln(P2/P1) = -ΔH/R (1/T2 – 1/T1)
όπου P1 και P2 είναι η τάση ατμών του υγρού στις θερμοκρασίες T1 και T2 αντίστοιχα, ΔH0 είναι η πρότυπη ενθαλπία εξάτμισης, και R είναι η γενική σταθερά των ιδανικών αερίων (universal gas constant). Από την ανωτέρω εξίσωση βλέπουμε ότι η τάση ατμών ενός υγρού είναι εκθετική συνάρτηση της απόλυτης θερμοκρασίας. Παρόμοιες συναρτήσεις συναντώνται και σε άλλες περιπτώσεις, όπως είναι η εξάρτηση από τη θερμοκρασία της σταθεράς ισορροπίας και της σταθεράς ταχύτητας μιας χημικής ή ενζυμικής αντίδρασης. Σε όλες τις παραπάνω περιπτώσεις, η εξάρτηση του μεγέθους τυου φαινομένου που μελετάται από την απόλυτη θερμοκρασία, εξηγείται με την κατανομή μοριακών ταχυτήτων σύμφωνα με το πρότυπο πάνω στο οποίο στηρίχτηκε η μαθηματική ανάλυση της κίνησης των μορίων ενός αερίου ή ενός υγρού, κατά τους Maxwell-Boltzmann.
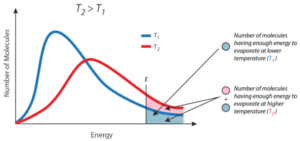
Στην περίπτωση της τάσης ατμών ενός υγρού λέμε ότι για να μεταβεί ένα μόριο ουσίας από την υγρή στην αέρια φάση, θα πρέπει να έχει ταχύτητα ίση ή μεγαλύτερη από μια ελάχιστη τιμή που ονομάζεται ταχύτητα διαφυγής των μορίων. Από το σχήμα βλέπουμε ότι το ποσοστό των μορίων ενός αερίου τα οποία έχουν την ταχύτητα διαφυγής (ή μεγαλύτερη απ’ αυτήν) αυξάνει με την αύξηση της θερμοκρασίας.
Σχήμα: Η ταχύτητα διαφυγής ενός μορίου του υγρού σαν συνάρτηση της απόλυτης θερμοκρασίας. Η σκιασμένη επιφάνεια αντιστοιχεί στα μόρια που έχουν ταχύτητα ίση ή μεγαλύτερη από την ταχύτητα διαφυγής.
Η διαλυτότητα των αερίων στα υγρά. Ο νόμος του Henry. Η διαλυτότητα των αερίων στα υγρά μελετήθηκε για πρώτη φορά από το Άγγλο Φυσικό και Χημικό William Henry (1775-1836). Ο Henry έκανε πειράματα πάνω στην ικανότητα του νερού να απορροφά διάφορα αέρια, όταν τα τελευταία βρίσκονται σε υψηλή πίεση πάνω από την επιφάνεια του υγρού και έφτασε στο συμπέρασμα ότι το ποσό του αερίου το οποίο απορροφάται από το υγρό, είναι κατ’ ευθείαν ανάλογο προς την πίεση του αερίου. Η αρχή αυτή είναι γνωστή σαν “ο νόμος του Henry”.
Όταν μελετάμε την απορρόφηση ενός αερίου από ένα υγρό, σε συνάρτηση με την πίεση του αερίου, συνήθως εκφράζουμε τα αποτελέσματα σαν μια συνάρτηση της πίεσης P του αερίου και της molality (m) του διαλυμένου αερίου P = f(m) ή του γραμμομοριακού κλάσματος x του διαλυμένου αερίου P = f(x). Στην πρώτη περίπτωση ο νόμος του Henry διατυπώνεται με τη σχέση:
Q = m/P
Όπου P είναι η πίεση του αερίου και m η Μοριακότητα κατά βάρος (molality) του διαλυμένου αερίου. Στη δεύτερη περίπτωση η διαλυτότητα του αερίου στο υγρό περιγράφεται με τη σχέση:
K = P/x
όπου x είναι το γραμμομοριακό κλάσμα του διαλυμένου αερίου. Σαν παράδειγμα του πρώτου είδους διατύπωσης δίνεται στον πίνακα η διαλυτότητα του διοξειδίου του άνθρακα στο νερό σε διάφορες θερμοκρασίες:
Πίνακας: Διαλυτότητα Q του CO2 στο νερό, και σε διάλυμα 0,2 M NaCl σαν συνάρτηση της θερμοκρασίας
| Θερμοκρασία (0C) | Q (σε Η2Ο) | Q (σε 0,2 M NaCl) |
| 0 | 0,0770 | 0,0726 |
| 10 | 0,0640 | 0,0610 |
| 20 | 0,0393 | 0,0373 |
| 25 | 0,0345 | 0,0328 |
| 30 | 0,0302 | 0,0286 |
| 35 | 0,0268 | 0,0255 |
| 38 | 0,0250 | 0,0238 |
| 40 | 0,0241 | 0,0229 |
| 50 | 0,0198 | 0,0190 |
Q = mCO2 / PCO2
mCO2 = n(moles CO2) /KgH2O
PCO2 = μερική πίεση CO2 (σε Atm).
Σαν παράδειγμα του δεύτερου είδους διατύπωσης, δίνεται η τιμή της σταθεράς του νόμου του Henry για διάφορα αέρια και με διαλύτες το νερό και το βενζόλιο.
Η σταθερά Κ του νόμου Henry για διάφορα αέρια.
| Αέριο | Διαλύτης – Νερό | Διαλύτης – Βενζόλιο |
| H2 | 5,34 x 107 | 2,75 x 106 |
| N2 | 6,51 x 107 | 1,79 x 106 |
| O2 | 3,30 x 107 | |
| CO | 4,34 x 107 | 1,22 x 106 |
| CO2 | 1,25 x 106 | 8,57 x 104 |
| CH4 | 3,14 x 107 | 4,27 x 105 |
| C2H2 | 1,01 x 106 | |
| C2H4 | 8,67 x 106 | |
| C2H6 | 2,30 x 107 |
Ο Dalton έδειξε ότι, για ένα μίγμα αερίων, η διαλυτότητα του καθενός αερίου είναι απ’ ευθείας ανάλογη με τη μερική του πίεση και έτσι είναι ουσιαστικά ανεξάρτητη από τη διαλυτότητα των άλλων αερίων. Η διαλυτότητα του οξυγόνου στο νερό είναι διπλάσια από αυτήν του αζώτου. Έτσι ο αέρας που είναι διαλυμένος στο νερό, είναι σημαντικά πλουσιότερος σε οξυγόνο απ’ ότι είναι ο αέρας που βρίσκεται πάνω απ’ την επιφάνεια του υγρού (Daniels & Alberty 1955).
Από τον πίνακα βλέπουμε ότι η απορρόφηση του διοξειδίου του άνθρακα από το νερό ελαττώνεται με την αύξηση της θερμοκρασίας, κάτι που βέβαια ισχύει για όλα τα αέρια γενικά. Έτσι είναι δυνατόν να αφαιρεθεί ο αέρας από ένα υδατικό διάλυμα με βρασμό, και στη συνέχεια ταχεία ψύξη του διαλύματος. Επειδή η ταχύτητα διάλυσης των αερίων στο νερό είναι σχετικά μικρή, είναι δυνατόν αυτό το φτωχό σε αέρια διάλυμα να χρησιμοποιηθεί για την απορρόφηση μιας μικρής ποσότητας ενός αερίου, πχ για την αφαίρεση φυσαλίδων αέρα από το υλικό μιας στήλης χρωματογραφίας.
Παράδειγμα:
Ζητείται ο υπολογισμός της διαλυτότητας του διοξειδίου του άνθρακα στο νερό, σε πίεση PCO2 = 1 Atm και στους 25 οC. Δεχόμαστε ότι ένα λίτρο (1 L) νερού ουσιαστικά περιέχει 1000 g νερού. Η σταθερά του νόμου Henry είναι 1,25 x 106 από τον πίνακα.
1,25 x 106 = (760/xCO2) = (760/nCO2) ( nCO2 + 1000/18)
Δεχόμαστε ότι ο αριθμός των moles του διαλυμένου διοξειδίου του άνθρακα (nCO2) είναι ασήμαντος σε σχέση με τον αριθμό των moles του νερού. Οπότε έχουμε:
1,25 x 106 = (760/nCO2) (55,5) Οπότε nCO2 = (760)(55,5)/(1,25 x 106) = 0,0337 mol/L
Η τιμή αυτή μπορεί να συγκριθεί με την τιμή 0,0345 του πρώτου πίνακα.
- Η διαλυτότητα ενός αερίου σε υγρά συνήθως μειώνεται με αύξηση της θερμοκρασίας, αφού η θερμότητα αποβάλλεται κατά τη διεργασία της διάλυσης. Είναι κοινή η παρατήρηση, ότι ένα ποτήρι με κρύο νερό, όταν θερμαίνεται σε θερμοκρασία δωματίου εμφανίζει πολλές μικρές φυσαλίδες αέρα. Υπάρχουν και αρκετές εξαιρέσεις όμως, ειδικά με διαλύτες όπως υγρή αμμωνία, λειωμένος άργυρος, και πολλά οργανικά υγρά.
- Η διαλυτότητα ενός αδρανούς αερίου, οφείλεται στις διαμοριακές ελκτικές δυνάμεις μεταξύ των μορίων του αερίου και των μορίων του διαλύτη. Υπάρχει καλή συσχέτιση μεταξύ της διαλυτότητας των αερίων σε διάφορους διαλύτες, και των σημείων ζέσεως των αερίων αυτών. Ενώσεις με χαμηλά σημεία ζέσεως (He, H2, N2, Ne κλπ), έχουν ασθενείς διαμοριακές έλξεις, και άρα δεν είναι ιδιαίτερα διαλυτές στα υγρά.
- Η διαλυτότητα των αερίων στο νερό, συνήθως μειώνεται με την προσθήκη άλλων διαλυμένων ουσιών, ιδιαίτερα ηλεκτρολυτών. Η έκταση αυτής της “εξαλάτωσης” ποικίλει μεταξύ διαφορετικών αλάτων, όμως προκειμένου για το ίδιο άλας, η σχετική μείωση στη διαλυτότητα είναι σχεδόν η ίδια για τα διάφορα αέρια. Η διαλυτότητα των υγρών και στερεών στο νερό επίσης εμφανίζεται το φαινόμενο της εξαλάτωσης.
Αφήστε μια απάντηση
Για να σχολιάσετε πρέπει να συνδεθείτε.