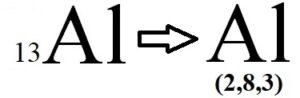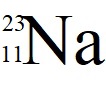Καταφορτώστε τον παρακάτω “άδειο από χημικά στοιχεία Περιοδικό Πίνακα”
Άδειος Περιοδικός Πίνακας
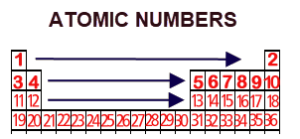
Στη συνέχεια τοποθετήστε ΚΑΤΑΛΛΗΛΑ τα πρώτα 18 στοιχεία του Περιοδικού Πίνακα, βρίσκοντας τον Ατομικό τους αριθμό από τον παρακάτω πίνακα
Ατομικοί Αριθμοί Χημικών Στοιχείων
και κάνοντας ηλεκτρονιακή κατανομή όπως το παρακάτω παράδειγμα:
Ελέγξτε την ορθότητα του πίνακα που δημιουργήσατε ακολουθώντας τον παρακάτω συνδέσμου:
Τα 18 πρώτα στοιχεία του Περιοδικού Πίνακα με κατανομή ηλεκτρονίων σε στοιβάδες
ή μέσω της εικόνας που ακολουθεί (κάντε κλικ στην εικόνα για να τη μεγενθύνετε)
Συμπεράσματα – γνώσεις για τον Περιοδικό Πίνακα
Η ενότητα στο σχολικό βιβλίο είναι στις σελίδες 47-51 . Μπορείτε να τη διαβάσετε κάνοντας κλικ εδώ στο ηλεκτρονικό βιβλίο.
-
Ο σύγχρονος περιοδικός πίνακας είναι μια κατάταξη των χημικών στοιχείων κατά αύξοντα ατομικό αριθμό.
-
Στοιχεία με τον ίδιο αριθμό e- στην εξωτερική τους στοιβάδα, τοποθετούνται το ένα κάτω από το άλλο (κάντε κλικ στην εικόνα για να τη μεγενθύνετε).
-
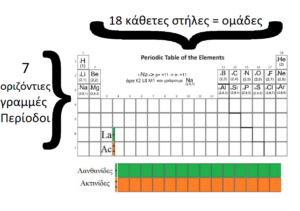
Περιλαμβάνει επτά οριζόντιες γραμμές, οι οποίες ονομάζονται περίοδοι, και δεκαοκτώ κατακόρυφες στήλες, οι οποίες ονομάζονται ομάδες.
-
Οι κύριες ομάδες του Περιοδικού Πίνακα είναι οι ομάδες 1,2, 13, 14, 15, 16, 17 & 18 ενώ οι Δευτερεύουσες (ή στοιχεία Μετάπτωσης) οι 3,4,5,6,7,8,9,10,11 & 12
(κάντε κλικ στην εικόνα για να τη μεγενθύνετε)
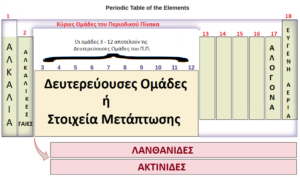
-
Ορισμένες ομάδες στοιχείων του πίνακα έχουν ιδιαίτερα ονόματα. Έτσι:
-
τα στοιχεία της 1ης ομάδας, εκτός από το υδρογόνο, ονομάζονται αλκάλια
-
τα στοιχεία της 2ης ομάδας ονομάζονται αλκαλικές γαίες
-
τα στοιχεία της 17ης ομάδας ονομάζονται αλογόνα και
-
τα στοιχεία της 18ης ομάδας ονομάζονται ευγενή αέρια
-
-
Οι ιδιότητες των χημικών στοιχείων καθορίζονται από τον τρόπο που είναι κατανεμημένα τα ηλεκτρόνια στις στιβάδες. Τα στοιχεία των οποίων τα άτομα έχουν τον ίδιο αριθμό ηλεκτρονίων στην εξωτερική στιβάδα, δηλαδή στην πιο απομακρυσμένη στιβάδα από τον πυρήνα, έχουν (συνήθως) παρόμοιες ιδιότητες.
-
Ο αριθμός των στιβάδων που που έχουν κατανεμηθεί τα ηλεκτρόνιά ενός στοιχείου, της περιόδου δείχνει την Περίοδο που ανήκει το στοιχείο, ενώ ο αριθμός των e- στην εξωτερική στοιβάδα, δείχνει την κύρια ομάδα του Περιοδικού Πίνακα που ανήκει το χημικό στοιχείο. Π.χ. αν γνωρίζουμε ότι το χημικό στοιχείο Νa (νάτριο) έχει ατομικό αριθμό 11, τότε μπορούμε να βρούμε τη θέση του στον Περιοδικό Πίνακα αφού: