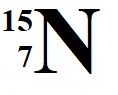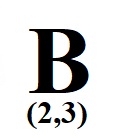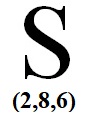Στο 1ο μάθημα μας, θυμηθήκαμε από τη Β΄Γυμνασίου τη δομή του ατόμου τι είνα ι ο ατομικός και τι ο μαζικός αριθμός.
ι ο ατομικός και τι ο μαζικός αριθμός.
Στο σημερινό μάθημα θα αναφερθούμε στον Niels Bohr και τι ανέφερε η θεωρία του το 1913 σχετικά με το πως κινούνται τα e (ηλεκτρόνια) γύρω από τον πυρήνα.
Σύμφωνα με τη θεωρία του:
-
Τα ηλεκτρόνια e– κινούνται σε διάφορες κυκλικές τροχιές όπως οι πλανήτες γύρω από τον Ήλιο
-
Οι κυκλικές αυτές τροχιές, ονομάζονται στοιβάδες.
-
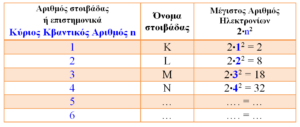
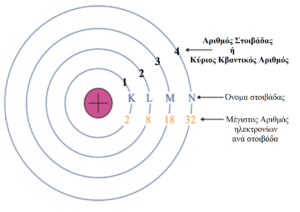
Η πιο κοντινή στοιβάδα στον πυρήνα είναι η 1η στοιβάδα και ονομάζεται Κ
-
Η 2η στοιβάδα ονομάζεται L, η 3η στοιβάδα ονομάζεται M κ.ο.κ.
-
Ο αριθμός της στοιβάδας ονομάζεται κύριος κβαντικός αριθμός και συμβολίζεται με n. Δηλ. η στοιβάδα Κ έχει n=1, η L έχει n=2 κ.ο.κ.
-
Ο μέγιστος αριθμός e– σε κάθε στοιβάδα, δίνεται από τον τύπο 2•n2
Όλα τα παραπάνω συνοψίζονται στον πίνακα που ακολουθεί:
Ακολουθεί η σχηματική αναπαράσταση του ατομικού μοντέλου του Bohr:
Κατανομή e– σε στοιβάδες
Όταν πρόκειτε να κάνουμε την κατανομή των e– σε στοιβάδες, ξεκινάμε να τα τοποθετούμε από τη στοιβάδα Κ που είναι πιο κοντά στον πυρήνα, αφού τη συμπληρώσουμε τα τοποθετούμε στην επόμενη που είναι η L, που αν συμπληρώνεται προχωρούμε στην Μ κ.ο.κ. Αυτό συμβαίνει γιατί τα e– είναι αρνητικά και θέλουν να βρίσκονται όσο πιο κοντά γίνεται στον πυρήνα που είναι θετικός.
Παρακολουθήστε όλα τα παραπάνω μέσω του βίντεο του χημικού Κώστα Κωτελίδα
Παραδείγματα εφαρμογής του Μοντέλου Bohr.
Άζωτο
Πρωτόνια = 7 άρα και
ηλεκτρόνια =7 οπότε
Κ2 L5 και το γράφουμε ως
Αργίλιο
Πρωτόνια = 13 άρα και
ηλεκτρόνια =13 οπότε
Κ2 L8 Μ3 και το γράφουμε ως
Βόριο
Πρωτόνια = 5 άρα και
ηλεκτρόνια =5 οπότε
Κ2 L3 και το γράφουμε ως
Θείο
Πρωτόνια = 16 άρα και
ηλεκτρόνια =16 οπότε
Κ2 L8 Μ6 και το γράφουμε ως
Φθόριο
Πρωτόνια = 9 άρα και
ηλεκτρόνια =9 οπότε
Κ2 L7 και το γράφουμε ως