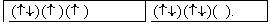Περιοδικός Πίνακας και ιδιότητες στοιχείων.
Δίνεται ο παρακάτω υποθετικός Περιοδικός Πίνακας
|
Α |
|||||||
|
Λ |
Β |
Μ |
Ε |
Ζ |
|||
|
Δ |
Η |
||||||
|
Θ |
|||||||
|
Γ |
Κ |
i) Ποιο από όλα τα στοιχεία έχει μεγαλύτερη ενέργεια ιοντισμού και ποιο τη μικρότερη;
ii) Το οξείδιο του Λ είναι όξινο ή βασικό;
iii) Το οξείδιο ενός στοιχείου είναι επαμφοτερίζον. Ποιο μπορεί να είναι το στοιχείο;
iv) Ποιο στοιχείο έχει μεγαλύτερη ακτίνα το Ε ή το Ζ και γιατί;
v) Ποιο στοιχείο έχει μεγαλύτερη ακτίνα το Δ ή το Β και γιατί;
vi) Ποιο στοιχείο έχει μεγαλύτερη ενέργεια πρώτου ιοντισμού το Ε ή το Ζ και γιατί;
vii) Ποιο στοιχείο έχει μεγαλύτερη ενέργεια πρώτου ιοντισμού το Γ ή το Δ και γιατί;
viii)Η ενέργεια πρώτου ιοντισμού του στοιχείου Λ είναι 10kJ/mol. Η ενέργεια δεύτερου ιοντισμού του ίδιου στοιχείου μπορεί να είναι:
α) 8 kJ/mol β) 10 kJ/mol γ) 15 kJ/mol δ) 45 kJ/mol
Ενέργεια ηλεκτρονίου.
Να χαρακτηρίστε τις παρακάτω προτάσεις σαν σωστές ή λαθεμένες.
i) Η ενέργεια ενός ηλεκτρονίου καθορίζεται περισσότερο από την έλξη του πυρήνα και λιγότερο από τις διηλεκτρονιακές απώσεις.
ii) Όταν οι ελκτικές δυνάμεις είναι μεγάλες, το ηλεκτρόνιο έχει μικρή ενέργεια.
iii) Η υποστιβάδα 3p έχει μικρότερη ενέργεια απ? ότι η υποστιβάδα 4s.
iv) Από τις επόμενες δύο κατανομές για τα ηλεκτρόνια της υποστιβάδας p, μικρότερη ενέργεια έχει η πρώτη.
ΓΕΝΙΚΟ ΔΙΑΓΩΝΙΣΜΑ ΧΗΜΕΙΑΣ.
Μια ακόμη προσφορά από τον συνάδελφο Χημικό Νίκο Καχριμάνη.
Διαθέτουμε ένα δείγμα υδροξειδίου του νατρίου (ΝaΟΗ). Γνωρίζουμε ότι οι προσμίξεις δεν εμφανίζουν αλκαλικές ιδιότητες. Για να βρούμε λοιπόν πόση είναι η περιεκτικότητα του δείγματος σε καθαρό υδροξείδιο του νατρίου, εργαζόμαστε ως εξής:
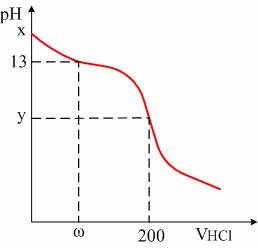
Διαλύουμε 5g του δείγματος σε νερό, οπότε προκύπτει διάλυμα όγκου 100ml. Παίρνουμε 20ml αυτού του διαλύματος και ογκομετρούμε με πρότυπο διάλυμα υδροχλωρίου (HCl) 0,1Μ. Η καμπύλη της ογκομέτρησης φαίνεται στο σχήμα.
i) Πρόκειται για οξυμετρία ή αλκαλιμετρία; Να δικαιολογήσεις την απάντησή σου.
ii) Να υπολογίσεις τα γραμμάρια του καθαρού υδροξειδίου του νατρίου που
περιέχονταν στα 5g του δείγματος.
Δίνονται οι σχετικές ατομικές μάζες: Νa = 23, O = 16 και Η = 1.
iii) Να υπολογίσεις το x, δηλαδή το αρχικό pH του διαλύματος που ογκομετρήθηκε και το y, δηλαδή το pH του διαλύματος στο ισοδύναμο σημείο.
iv) Να υπολογίσεις το ω, δηλαδή πόσος όγκος είχε προστεθεί από το πρότυπο διάλυμα τη στιγμή που το pH στο ογκομετρούμενο διάλυμα ήταν 13.
Όλα τα διαλύματα βρίσκονται στους 25oC, όπου ισχύει KW = 10-14.
Μπορείτε να κατεβάσετε όλο το διαγώνισμα με σύντομες απαντήσεις από ΕΔΩ.
Περιοδικός Πίνακας ιδιότητες και δεσμοί στοιχείων.
Δίνεται το ακόλουθο τμήμα του Περιοδικού Πίνακα:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
και τα στοιχεία: 9F, 26Fe, 12Mg, 19K, 11Na, 5B, 8O, 30Zn, 18Ar.
1. Να τοποθετήσετε τα παραπάνω στοιχεία στη θέση τους στον Π.Π. Σε ποιον τομέα ανήκει το καθένα από αυτά.
2. Ποιος είναι ο ατομικός αριθμός για τα στοιχεία Α, Β, Γ και Δ; Σε ποιόν τομέα ανήκει το καθένα από αυτά;
3. Ποιο από αυτά με την πρόσληψη ενός ηλεκτρονίου και πιο με την αποβολή δυο ηλεκτρονίων αποκτά δομή ευγενούς αερίου.
4. Τι είδους δεσμό δημιουργεί το Β με το Δ; Να γραφεί ο ηλεκτρονιακός τύπος της ένωσης.
5. Να κατατάξετε τα στοιχεία Α, Β, Γ και Δ κατά αύξουσα ατομική ακτίνα και κατά αύξουσα Ε1i.
Από ένα διαγώνισμα, προσφορά του συναδέλφου Νίκου Καχριμάνη.
Δείτε όλο το διαγώνισμα από ΕΔΩ.
Ιοντικές – Ομοιοπολικές ενώσεις.
Να μελετήσετε τον παρακάτω συνοπτικό Π.Π. και να απαντήσετε στις ερωτήσεις που ακολουθούν:
|
3Li |
4Be |
5B |
6C |
7N |
8O |
9F |
10Ne |
|
11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
18Ar |
|
19K |
20Cα |
|
|
|
|
35Br |
|
|
27Rb |
|
|
|
|
|
53I |
|
|
55Cs |
|
|
|
|
|
85At |
|
α) Ποιος συνδυασμός στοιχείων θα δώσει την πιο ιοντική ένωση;
β) Ποια στοιχεία έχουν τις ηλεκτρονικές δομές:
i) 1s2 2s2 2p6 3s2 3p1
ii) 1s2 2s2 2p6 3s2 3p6
γ) Ποιο από τα στοιχεία Να, Rb, CΙ έχει τη μεγαλύτερη πρώτη ενέργεια ιοντισμού;
δ) Ποιο από τα οξείδια στις παρακάτω σειρές θα είναι πιο όξινο:
i) Β2Ο3, CΟ2, RbO. ii) SiΟ2, Η2Ο, Cl2Ο.
ε) Δίνονται οι ενώσεις:
i) RbΒr, CsF, ΑlCl3
ii) ΜgΟ, CαΟ, Κ2Ο, Ρ2Ο3.
iii) Β2Ο3, Αl2Ο3, SiΟ2, Ο2, SΟ2.
Κατατάξτε τις ενώσεις κάθε ομάδας από την πλέον ιοντική προς την πλέον ομοιοπολική.
Ενέργειες Ιοντισμού.
Ένα στοιχείο Χ έχει ενέργειες ιοντισμού Εi1=9,32eV, Εi2=18,2eV και Εi3=153,9eV. Σε ποια ομάδα του Π. Π. ανήκει το στοιχείο αυτό;
Περιοδικός πίνακας και ιδιότητες στοιχείων.
Τα στοιχεία Α-Ε έχουν ατομικούς αριθμούς Α=11, Β=15, Γ=17, Δ=36 και Ε=50. Ποιο από τα Α-Ε:
i) είναι μονοσθενές μέταλλο,
ii) έχει την μικρότερη ατομική ακτίνα,
iii) έχει οξείδιο που είναι ιοντική ένωση,
iv) έχει ένωση με υδρογόνο που είναι ισχυρό οξύ,
v) σχηματίζει ένωση του γενικού τύπου ΧCΙ4,
vi) είναι το περισσότερο ηλεκτραρνητικό,
vii) υφίσταται ως διατομικό αέριο;
Π.Μ.Δ.Χ. 1992
Περιοδικός Πίνακας
Δύο στοιχεία Σ1 και Σ2 των οποίων οι ατομικοί αριθμοί Z1 και Ζ2 (Ζ2 > Z1) διαφέρουν κατά 1 βρίσκονται σε διαφορετικές περιόδους του Π.Π.
α) Βρείτε τις ομάδες του Π.Π. στις οποίες ανήκουν τα στοιχεία Σ1 και Σ2.
β) Αν το στοιχείο Σ3 με ατομικό αριθμό Ζ3 = Ζ2 + 17 ανήκει στην ίδια ομάδα του Π.Π. με το Σ2, βρείτε τους ατομικούς αριθμούς Z1, Z2 και Ζ3 των στοιχείων Σ1, Σ2 και Σ3, αν ο ατομικός αριθμός του στοιχείου Σ1 είναι μικρότερος του 30
Στιβάδα-υποστιβάδα-τροχιακό.
Να συμπληρώσετε τον πίνακα με το μέγιστο αριθμό ηλεκτρονίων που μπορεί να περιέχονται στην αντίστοιχη στιβάδα, υποστιβάδα, ατομικό τροχιακό ή άτομο,
Δομή ατόμων.
Ποιες από τις παρακάτω προτάσεις είναι σωστές και ποιες λάθος.
α) Η ενέργεια ενός ηλεκτρονίου καθορίζεται περισσότερο από την έλξη του πυρήνα και λιγότερο από τις διηλεκτρονιακές απώσεις.
β) Όταν οι ελκτικές δυνάμεις είναι μεγάλες, το ηλεκτρόνιο έχει μικρή ενέργεια.
γ) Η υποστιβάδα 3p έχει μικρότερη ενέργεια απ? ότι η υποστιβάδα 4s.
δ) Από τις επόμενες δύο κατανομές για τα ηλεκτρόνια της p, μικρότερη ενέργεια έχει η πρώτη.